La molécule d'eau
La molécule d’eau : une structure atomique simple.
La molécule d’eau est formée d’un atome d’oxygène et de deux atomes d’hydrogène (fig. 1). Dans une molécule, les atomes se lient en mettant en commun une partie de leurs électrons, ceux qui sont situés sur la couche (ou orbitale) la plus externe par rapport au noyau afin de la « saturer ». L’atome d’oxygène possède six électrons périphériques, l’atome d’hydrogène un seul. Ces mises en commun se traduisent par des forces ou « liaisons » entre les atomes d’une même molécule. Ces liaisons et ces électrons périphériques confèrent à la molécule ses propriétés physico-chimiques. Les liaisons peuvent être plus ou moins solides. Dans la molécule d’eau, l’atome d’oxygène (O) met en commun deux électrons (on parle de paire ou de doublet) chacun avec un atome d’hydrogène (H). La liaison O-H (fig.1a) est une liaison dite de covalence[2]. Il y a donc deux liaisons covalentes dans la molécule d’eau. Ces liaisons sont beaucoup plus solides que les liaisons H (voir ci-dessous la description des liaisons H).
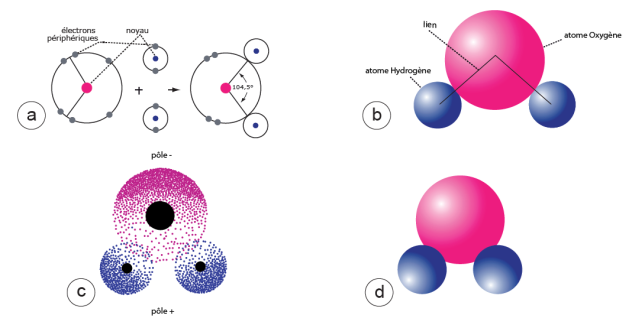
Figure 1. La molécule d’eau.
a) La molécule d’eau est formée d’un atome d’oxygène (O) et de deux atomes d’hydrogène (H). L’atome d’oxygène a six électrons dans sa couche périphérique ; l’atome d’hydrogène n’en a qu’un. La mise en commun de deux électrons périphériques entre l’atome H et l’atome O produit une liaison covalente, solide (lignes noires). L’angle formé par le noyau O et les deux hydrogènes est de 104,5 °.
b) Représentation conventionnelle de la molécule d’eau. D’après Salem, 1979.
c) La molécule d’eau est un dipôle : du fait de la dissymétrie de la répartition des charges positives (+) et négatives (-) (illustrée par la densité inégale des points), la molécule d'eau est d’un côté plutôt négative, de l’autre plutôt positive. Chacun de ces ensembles, composés de charges positives et de charges négatives séparées par une certaine distance, forme un dipôle. La nature dipolaire de la molécule d’eau est un élément déterminant des propriétés chimiques de l’eau.
d) Autre représentation usuelle de la molécule d’eau.
NB : ni les dimensions respectives des noyaux et des électrons ni les distances entre eux ne sont respectés dans ces dessins. D’après Caro, 1990, modifié.
Comme toute molécule, celle de l’eau possède un volume et une forme (fig. 1 et 3a), lesquels sont déterminés par l’emplacement respectif dans l’espace des atomes qui la constituent. L’atome d’oxygène forme avec les deux atomes d’hydrogène un angle de 104,5 degrés[3]. La distance entre les noyaux oxygène et hydrogène est d’un peu moins de 1 Å[4] à l’état vapeur. Le diamètre de la molécule est de plus du double, soit 2,82 Å. Les six électrons périphériques de l’atome d’oxygène sont répartis de la façon suivante : deux paires (ou doublets) et deux électrons célibataires. Chacun de ces électrons célibataires est associé à l’électron libre d’un atome d’hydrogène pour former une liaison covalente. Dans ces conditions, la couche externe de l’atome d’oxygène est formée de huit électrons (fig. 1a) : les 2 des atomes d’hydrogène et les six électrons périphériques de l’oxygène. C’est une configuration qui se caractérise par une grande stabilité chimique ; pour en donner une idée, il faudrait placer la molécule d’eau dans un four spécial et chauffer à plus de 2000°C pour casser la molécule (Salem, 1979).
Une molécule d’eau, comme n’importe quelle molécule, bouge sans arrêt à grande vitesse selon trois types de mouvements : vibration, rotation sur elle-même à environ 1015 tours par seconde, translation. A chacun de ces modes correspondent des niveaux différents d’énergie mise en œuvre. De plus, en même temps mais à des vitesses plus grandes encore, les atomes bougent les uns par rapport aux autres, eux aussi selon des modalités similaires. La connaissance des niveaux d’énergie impliqués dans ces différents mouvements est primordiale pour interpréter les propriétés d’absorption de rayonnements très différents (infrarouge, radio, hyperfréquences…) de la molécule d’eau et pour mieux comprendre la structure de l’eau liquide en particulier. Celle-ci est encore loin d’être parfaitement comprise.
La molécule d’eau est un dipôle.
Dans un atome le noyau est électriquement positif, les électrons au contraire électriquement négatifs. L’atome est normalement neutre s’il n’est pas ionisé. On vient de voir que dans la molécule d’eau, les trois atomes mettent en commun leurs 8 électrons périphériques, 6 pour l’oxygène et 1 pour chaque hydrogène. L’ensemble négatif de ces huit électrons circule à très grande vitesse autour de la partie positive du noyau, formant une espèce de coque où fusionne l’individualité de chacun d’eux. Mais cette coque, fortement attirée par le noyau (positif) d’oxygène laisse, en quelque sorte, en partie à découvert les charges positives des deux noyaux d’hydrogène. Tout en restant globalement neutre, la molécule présente donc un défaut de recouvrement des charges positives et négatives : ainsi est créé un dipôle, c’est-à-dire un ensemble de deux charges électriques séparées par une certaine distance, une sorte de petit aimant, légèrement positif du coté hydrogène, légèrement négatif du côté oxygène.
Une autre propriété essentielle découle de la fonction dipôle des molécules d’eau : leur orientation dans un champ électrique (fig. 2). En l’absence d’un tel champ, les molécules s’orientent de façon aléatoire. En présence de celui-ci elles s’orientent toutes plus ou moins parfaitement dans le sens du champ électrique. Cette orientation peut produire des effets très importants. Ainsi, par exemple, si l’on soumet des molécules d’eau au champ magnétique associé à des longueurs d’onde de l’ordre de 2 à 3 109 hertz[5], ces molécules absorbent l’énergie de ces micro-ondes. Par un mécanisme complexe faisant intervenir les liaisons H, cette énergie est rapidement transformée et utilisée de telle façon qu’elle accélère le mouvement brownien donc augmente la température. Cette propriété est utilisée dans les fours à micro-ondes pour chauffer les aliments.
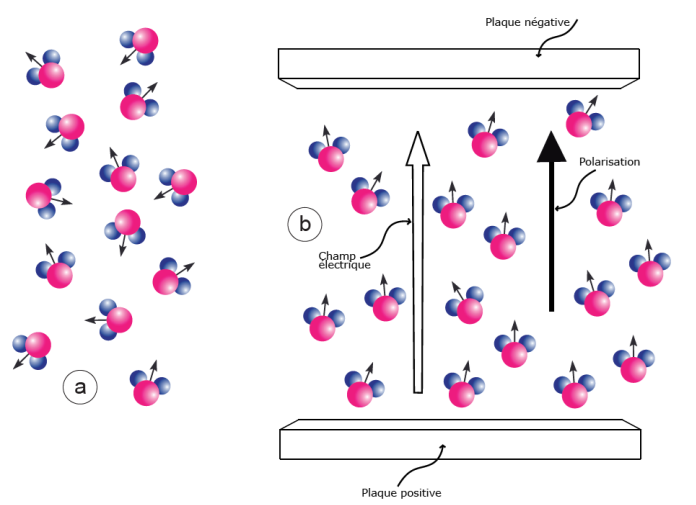
Figure 2. Influence d’un champ électrique sur la molécule d’eau en tant que dipôle. Ce dipôle est schématisé par la petite flèche accompagnant chaque molécule d’eau.
a) En l’absence de champ électrique ou électromagnétique, les molécules d’eau liquide sont orientées d’une façon aléatoire.
b) En présence d’un champ électrique, elles s’orientent globalement en fonction de la direction du champ. L’orientation n’est pas parfaite car l’agitation thermique peut bousculer les molécules. D’après Walker, 1987, modifié.
Du fait de ses propriétés de dipôle, la molécule d’eau est capable d’absorber les ondes électromagnétiques et de passer à des états « excités ». Ces états excités sont des états temporaires : la molécule ne garde pas longtemps l’énergie reçue par l’onde électromagnétique. Elle la dissipe sous forme de chaleur et revient ainsi à l’état de base. D’une façon générale les interactions entre l’environnement et l’eau (par l’apport de chaleur, par la lumière ou d’autres types de rayonnements) se traduisent par des « sauts » de la molécule d’eau d’un état de base à des états excités qui permettent des échanges d’énergie entre le milieu et la molécule (Caro, 1992).
La liaison « hydrogène », clé des propriétés de l’eau.
La liaison « hydrogène » (ou « liaison H ») est une liaison électrostatique entre molécules d’eau en particulier. Elle résulte de la structure de dipôle de l’eau. Elle s’établit entre l’un des atomes d’hydrogène chargé positivement, d’une molécule, et l’atome d’oxygène chargé négativement, d’une autre molécule voisine (fig. 3). Cette liaison a tendance à réaliser un alignement entre les trois atomes O-H-O de deux molécules d’eau[6]. Cependant l’agitation thermique, c’est-à-dire le mouvement perpétuel et désordonné des molécules dû à la température, entraîne dans l’eau liquide, une sorte de torsion des liaisons H qui leur donne une certaine liberté de mouvement.
Une molécule d’eau peut contracter plusieurs liaisons H avec ses voisines, en principe quatre : 2 par les doublets de l’atome d’oxygène et 2 par ses atomes d’hydrogène. Ces liaisons se font et se défont à des fréquences de l’ordre de 1012 fois par seconde.
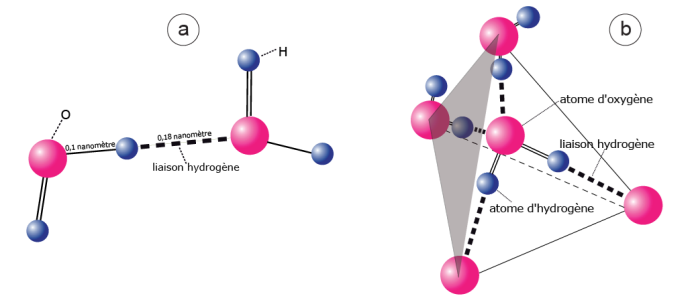
Figure 3. La liaison hydrogène ou liaison H.
a) Une liaison H se forme quand un atome d’hydrogène d’une molécule d’eau se lie à l’atome d’oxygène d’une autre molécule. Cette liaison est bien moins solide que la liaison covalente qui, dans la molécule d’eau, lie l’atome d’oxygène aux atomes d’hydrogène. La liaison H est responsable des propriétés spécifiques de l’eau.
b) Représentation tridimensionnelle de la molécule d'eau et des quatre liaisons H qu’elle peut former avec ses voisines immédiates dans la glace. La molécule d’eau peut s'inscrire dans un tétraèdre dont le centre est occupé par l'atome d'oxygène (O). Les sommets du tétraèdre sont occupés par les atomes d’oxygène des molécules voisines. Dans cette configuration, propre à la glace, la distance entre molécules est de 0,28 nanomètres (1 nanomètre est égal à un milliardième de mètre). D’après J. Teixeira, 2001.
On caractérise une liaison chimique par l’énergie mise en jeu pour la rompre : la liaison covalente exige environ 400 à 800 kj.mole-1 contre 8 à 40 pour une liaison hydrogène. Cela signifie que, contrairement aux liaisons covalentes très solides, les liaisons H peuvent, du fait de l’agitation thermique, se tordre, se rompre aux températures ordinaires.
Le nombre de ces liaisons H est dépendant de l’état de l’eau et de la température.
- A l’état gazeux, les distances entre molécules sont grandes (plusieurs fois ou dizaines de fois la dimension d’une molécule, et les liaisons H sont globalement inexistantes.
- A l’état liquide les liaisons H sont nombreuses mais leur nombre est fluctuant. Il diminue avec l’augmentation de la température. La conséquence la plus directe de cette variation du nombre de liaisons H avec la température est l’augmentation de la densité de l’eau liquide entre 0°C et 3,8°C : plus le nombre de liaisons H est grand, moins l’eau est dense car quand une liaison H se rompt, la distance entre molécules se réduit. Cependant, au-delà de 3,8°C, l’effet de l’agitation thermique l’emporte sur celui de la destruction des liaisons H ; par conséquent la densité décroît avec la température (fig. 17).
- A l’état solide (glace), une molécule d’eau peut participer à 4 liaisons H et former avec ses voisines immédiates un tétraèdre régulier (fig. 3b). La structure de la glace est dominée par l’arrangement des atomes d’oxygène : chacun a quatre voisins oxygène situés à la même distance (fig. 3b). Ainsi dans la glace chaque molécule d’eau est reliée aux autres par des liaisons H, trois dans un même plan, 4 dans l’espace (fig. 3 et 4). Autre point important, dans la glace ordinaire, les distances entre molécules (0,28 nanomètres) sont supérieures à celles qui existent entre molécules d’eau à l’état liquide. Cette disposition explique donc pourquoi la densité de la glace est inférieure à celle de l’eau liquide (d’environ 10 pour cent). En attendant de compléter quelque peu ces questions plus loin, on peut conclure en disant que les changements d’état de l’eau impliquent donc obligatoirement des variations du nombre des liaisons H.
Remarque. La densité d’un corps est le rapport de sa masse volumique à la masse volumique d’un corps pris comme référence (l’eau pour les solides et les liquides, l’air pour les gaz). L'ulidsisation de ce terme doit être évité autant que possible et remplacé par la masse volumique laquelle est le rapport de la masse d’un corps par unité de volume. La densité est un nombre sans dimension, la masse volumique s’exprime, elle, en kilo par m3 par exemple.
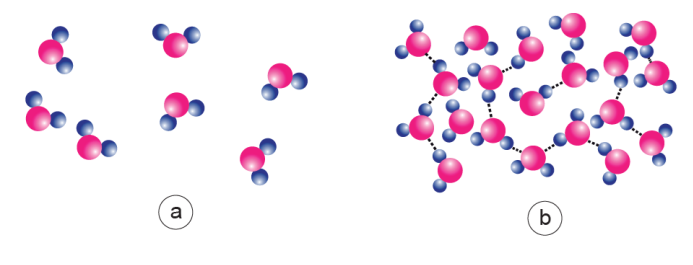
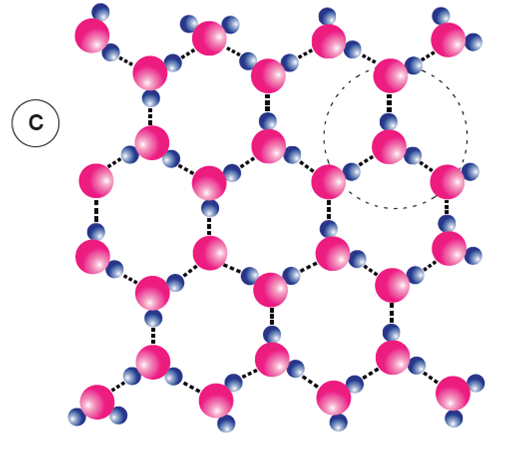
Figure 4. Liaisons H et états de l’eau. Le nombre de liaisons H entre molécules d’eau est dépendant de l’état physique de l’eau : gazeux, liquide ou solide.
a) A l’état gazeux, les molécules d’eau sont très éloignées les unes des autres ; il n’y a pas de liaisons H entre elles.
b) A l’état liquide, plusieurs liaisons H existent entre molécules d’eau, jusqu’à, en moyenne, un peu plus de 4 par molécule ; elles se font, se déforment et se défont constamment à des vitesses extrêmement rapides. Leur nombre diminue quand la température s’élève car elles sont cassées par l’agitation thermique.
c) À l’état solide, les molécules d’eau de la glace forment la trame d’un maillage très régulier, tétraédrique ; chaque molécule d’eau contracte, dans un plan horizontal, 3 liaisons H avec ses voisines (voir cercle pointillé). D’après P. Caro, 1990, modifié.
Les isotopes de l’eau.
Un élément chimique donné est caractérisé par les valeurs de deux nombres relatifs aux deux types de particules, appelées nucléons, composant son noyau : N, le nombre de neutrons non chargés, et Z le nombre de protons chargés positivement. Dans un élément chimique donné, il y a un nombre fixe d’électrons, égal au nombre de protons : ainsi l’hydrogène a un électron et un proton, le carbone a 6 électrons et 6 protons, l’oxygène 8 électrons[7] et 8 protons. Les masses du proton et du neutron étant très voisines, celle du noyau A, appelée masse atomique (ou nombre de masse), est donc de A = Z + N (fig. 5). Le nombre Z caractérise l’élément chimique et constitue le critère de sa position dans le tableau de la classification périodique des éléments ; par exemple pour l’hydrogène Z = 1 et pour l’oxygène, Z = 8.
Cependant, il existe dans la nature des éléments chimiques qui, bien qu’ayant le même nombre de protons Z, n’ont pas le même nombre de neutrons N. Ces noyaux ont des masses différentes mais ils appartiennent à la même « case » de la classification périodique des éléments. On qualifie ces atomes d’ « isotopes ». Un même élément chimique peut donc avoir plusieurs isotopes qui diffèrent par leur nombre de neutrons. Par exemple le carbone existe sous forme de trois isotopes : 14C, 13C et 12C: le chiffre en bas indique le nombre de protons Z, le chiffre en haut la masse atomique A[8].
Les isotopes ont des propriétés chimiques très voisines puisque ces propriétés résultent principalement de la couche d’électrons (ou orbitale) la plus externe, mais ils diffèrent par leurs propriétés physiques, puisque celles-ci sont surtout fonction de leur masse (protons et neutrons).
Dans la nature, les éléments chimiques sont très souvent des mélanges d’isotopes. Par exemple, l’hydrogène naturel est formé presque exclusivement (à plus de 99%) d’hydrogène « normal » à 1 proton (et pas de neutron), dénommé hydrogène H, et à moins de 1% d’un hydrogène particulier, le deutérium D, ayant un neutron et un proton. Le troisième isotope, le tritium, T ou 3H possédant 1 proton et 2 neutrons (fig. 5), instable, n’existe à l’état naturel que dans la haute atmosphère.
Les isotopes naturels de l’eau sont assez nombreux puisqu’ils résultent des possibilités de combinaison des isotopes de l’hydrogène (1H, l’hydrogène normal, 2H, le deutérium, 3H, le tritium) et de ceux de l’oxygène (16O, l’oxygène normal, 17O, et 18O). L’eau ordinaire est un mélange de ces différents isotopes, les rapports isotopiques étant :
1H/2H : 1/6900 (il y a donc 6900 fois plus d’isotopes 1H que d’isotopes 2H)
16O/17O/18O : 2500/1/5
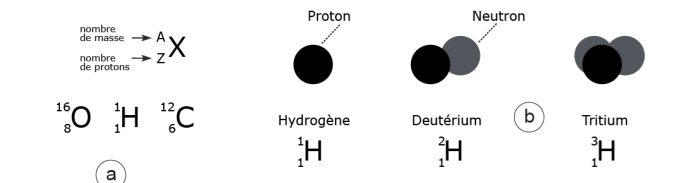
Figure 5. Rappels concernant les conventions de représentation chimique des éléments et des isotopes. a) En haut, X représente un élément chimique ; le chiffre représenté par la lettre A donne le nombre de masse (ou masse atomique) c’est-à-dire la somme des neutrons (N) et des protons (Z). Rappelons que le proton et le neutron sont des nucléons de charge électrique différente : le proton a une charge positive, le neutron une charge nulle. Le chiffre Z donne le nombre des protons. En dessous, trois exemples : l’oxygène avec 8 protons et 8 neutrons (soit un total de 16 nucléons) ; l’hydrogène (l’atome et non pas le gaz « hydrogène », molécule à deux atomes d’hydrogène) avec un seul proton et pas de neutron (donc A=Z) ; le carbone avec 6 protons et 12 nucléons. b) Les trois isotopes de l’hydrogène : l’hydrogène « normal », le plus abondant ; le deutérium dont le noyau possède un proton et un neutron et enfin le tritium, radioactif, dont le noyau comprend 1 proton et 2 neutrons.
L’existence du deutérium et de l’oxygène 18, isotopes les plus abondants de l’hydrogène et de l’oxygène, conduit à des formes « isotopiques » de la molécule d’eau, comme HDO (ou eau « semi-lourde», une molécule formée d’un atome d’hydrogène, d’un atome de deutérium et d’un atome d’oxygène), H2 18O (deux atomes H et un atome d’oxygène 18), qui sont présentes partout où se trouve de l’eau « normale » H2 O16. Dans l’eau, en moyenne, le rapport H2 18O/ H2 O16 est de l’ordre de 1/500 (car 5/2500, cf. supra).
Un isotope peut être stable ou radioactif. Sont stables ceux dont le noyau reste inchangé dans les processus dans lesquels il est engagé. Cette stabilité résulte du fait de la liaison très forte existant entre neutrons et protons. Dans un isotope radioactif au contraire les forces de liaison entre nucléons sont faibles si bien qu’au cours du temps l’isotope se décompose et se transforme en d’autres noyaux, par exemple par perte ou gain de neutrons ou de protons.
L’utilisation des isotopes stables et radioactifs est devenue depuis quelques décennies un outil indispensable en physiologie végétale (et animale) du fait de la possibilité qu’ils offrent d’être repérés et suivis (ce qu’on appelle le marquage).
On peut donc, grâce à eux, « marquer » un ou plusieurs atomes constitutifs d’une molécule sans en modifier les propriétés chimiques. Ces isotopes permettent ainsi d’étudier un grand nombre de phénomènes biologiques comme par exemple :
- la localisation d’une substance dans un organe ou dans une cellule,
- le suivi de la dégradation d’une substance,
- la caractérisation des transferts d’eau et d’ions dans les différentes parties d’une plante,
- la détermination des lieux de synthèse d’hormones et des modalités de leur action,
- la détermination de la profondeur moyenne d’absorption de l’eau par les racines (Bariac et al. 1987).
Les propriétés des isotopes de l’eau (il s’agit ici des isotopes stables) se manifestent en particulier lors des changements d’état physique de l’eau (ex : évaporation, condensation, voir § suivant) : du fait principalement de leur différence de masse, il s’opère en effet à cette occasion une sorte de tri entre isotopes. On parle de fractionnement isotopique. Voici deux exemples :
- lorsque l’eau s’évapore, les molécules H2 O16 plus légères que les molécules H2 O18, passent plus nombreuses en phase vapeur. En conséquence la vapeur d’eau est moins riche en H2 O18 que l’eau qui lui a donné naissance,
- lors d’une condensation, au contraire, les molécules H2 O18 se condensent plus facilement que les molécules d’eau « normale », H2 O16. Ainsi les masses d’air qui migrent vers les pôles s’appauvrissent en H2 O18 à cause des condensations successives alors que les pluies qui en proviennent s’enrichissent, quant à elles, en H2 O18. Ce fractionnement dépendant de la température, on utilise ces discriminations isotopiques pour reconstituer, en partie du moins, les paléoclimats à partir d’échantillons (Jouzel, Lorius et Raynaud, 2008).
[2] Une liaison covalente (ou covalence, ou liaison par électrons partagés), est assurée par un doublet d’électrons commun aux deux atomes. C’est l’un des types de liaison entre les atomes d’une molécule.
[3] Donc très proche de la valeur de l’angle central (109°) d’un tétraèdre régulier (angle formé par les lignes partant du centre vers les quatre sommets) ; voilà la raison pour laquelle on peut inscrire la molécule d’eau dans un tétraèdre.
[4] Un Angström (abréviation Å) vaut 10-10 mètre soit 1 dix millionième de mm ou encore 0,1 nanomètre.
[5] L’hertz est une unité de mesure de fréquence (ou oscillations par seconde) d’un phénomène périodique.
[6] La liaison H existe aussi dans des molécules autres que l’eau comme l’ammoniac NH3 par exemple.
[7] Six dans l’orbitale la plus externe et deux dans une orbitale sous-jacente.
[8] Dans les tableaux de la classification périodique des éléments c’est la convention inverse qui a été généralement choisie : la masse atomique A, est en bas !
Sommaire :
- I. OUTILS ET CONCEPTS DE BASE
- II. ETATS ET TRANSFERTS HYDRIQUES DANS ET À TRAVERS LA PLANTE
- II.1. La cellule en tant que compartiment hydrique
- Introduction : la cellule végétale vivante
- Le potentiel hydrique de la cellule et ses composantes.
- Relation potentiel hydrique – volume cellulaire : le diagramme de Höfler
- L’osmorégulation
- Les transferts d’eau transmembranaires
- Importance des relations hydriques pour l’expansion cellulaire
- Mesure des composantes du potentiel hydrique cellulaire
- Références bibliographiques
- II.2. Anatomie des voies de transfert de l’eau dans la plante
- II.3. L'eau dans les tissus et les organes de la plante et ses méthodes de caractérisation
- II.4. L’absorption de l'eau du sol par les racines
- II.5. La transpiration foliaire
- II.6. Transferts et états hydriques dans le continuum Sol-Plante-Atmosphère
- II.7. L’architecture hydraulique, la cavitation et l’embolie des plantes
- II.8. Un modèle simple de fonctionnement hydrique à l'échelle de la plante entière. Application pour un arbre
- II.9. Les flux de sève dans la plante : couplage entre xylème et phloème, modélisation
- II.10. L’eau et le métabolisme carboné : C3/C4, CAM ; efficience de l’eau
- II.1. La cellule en tant que compartiment hydrique
- III. FONCTIONNEMENT DES VEGETAUX EN SITUATION DE STRESS LIE A L’EAU
- III.1. Les végétaux face à la sécheresse
- III.2. Efficience agronomique de l’eau
- Les composantes de l’efficience d’utilisation de l’eau par les cultures.
- Nécessité de quantifier séparément Evaporation du sol et Transpiration des plantes
- Les interactions entre nutrition azotée et alimentation hydrique, conséquence sur l’efficience d’utilisation de l’eau par les cultures.
- Références bibliographiques
- IV. AGRONOMIE DE L’EAU





