Le transport de la sève des racines aux feuilles
5.1. Complexité spatiale du système vasculaire à l’échelle de la plante entière
Jusqu’à présent nous avons vu quels étaient les éléments conducteurs de la sève brute ainsi que quelques unes de leurs caractéristiques. Rien n’a encore été précisé quant à l’organisation spatiale de ces éléments dans la plante. Ce paragraphe donne quelques exemples de cette complexité anatomique dont la finalité est d’alimenter en eau chaque organe du végétal.
Le système vasculaire forme un réseau tridimensionnel se déployant dans toute la plante, qui évolue constamment dans le temps, avec les différentes phases du développement, notamment l’apparition de nouveaux organes (axes, feuilles, fleurs, fruits) qui doivent être alimentés, et la croissance en diamètre et en longueur des axes. Nous présentons ci-dessous quelques exemples qui illustrent la complexité spatio-temporelle du système vasculaire :
• La vascularisation d’un pied de tomate (Fig. 41). Cette représentation en deux dimensions montre l’organisation du réseau vasculaire. On peut y distinguer quelques-unes des propriétés de cette vascularisation : le fait que les voies de conduction pour chaque organe sont bien individualisées mais qu’en même temps elles sont interconnectées les unes aux autres, ce qui conduit à l’existence de plusieurs trajets possibles, voire beaucoup, pour relier des organes entre eux.
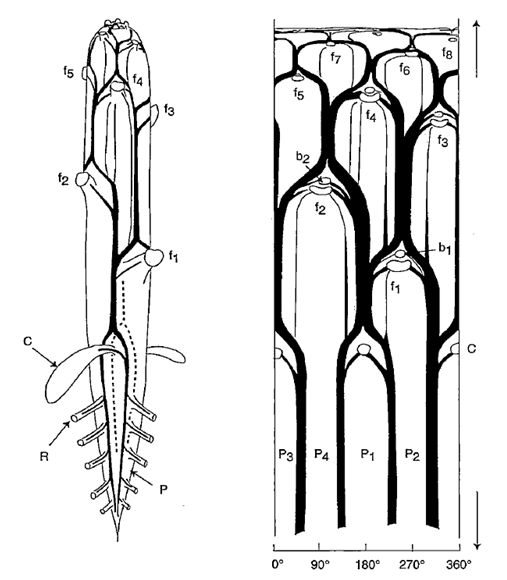
Figure 41. Disposition des faisceaux de xylème dans une plantule de tomate. A gauche : schéma de la plantule dont les feuilles ont été sectionnées. Le rapport diamètre / longueur a été multiplié par 4. (P : pivot ; R : racines latérales le long des pôles xylémiens ; C : cotylédons ; f1, f2, … : feuilles). A droite : représentation développée de la vascularisation (la plantule est assimilée à un cylindre fendu selon une génératrice). Les insertions des feuilles (f1, f2,…) et des bourgeons (b1, b2,…) sont indiquées. Noter la continuité entre la vascularisation du pivot (4 pôles xylémiens P1 à P4) et celle de la tige. Figure et légende sont tirées de André (2002).
On trouve dans la littérature de nombreuses expériences mettant en œuvre des colorants, injectés en solution dans une tige, expériences très souvent réalisées sur les arbres[14]. Après une certaine durée, correspondant au délai pour que la transpiration entraîne le colorant (fuschine, éosine, …) suffisamment loin du point d’injection, le végétal est découpé afin de suivre le déplacement et la répartition de la coloration entre et au sein des différents organes. Ces expérimentations simples conduisent généralement aux conclusions suivantes : i) le trajet est globalement vertical ; ii) malgré tout, on observe souvent un mouvement en spirale dans la tige ; iii) le colorant a tendance à diffuser latéralement, ce qui fait qu’à une grande distance de l’injection, il sera réparti dans l’ensemble de la section transversale. Une conséquence importante est qu’il n’y a pas, sur les végétaux de grande dimension (i.e. trajet long) de correspondance entre une racine et un rameau ou une branche
La complexité de ce réseau de distribution de l’eau dans toutes les parties vivantes d’un végétal peut être analysée en faisant appel à des concepts et des méthodes utilisés en électricité (cf. Chap. II. 6 et II.8) ou au moyen de l’analyse compartimentale (Chap. I.2) utilisée en biologie médicale ou en écologie.
5. 2 Le transport de la sève brute dans le bois des arbres.
Nous avons vu dans le § 3.5 de ce chapitre qu’à partir de leurs caractéristiques anatomiques à l’échelle cellulaire on pouvait distinguer plusieurs grands types de bois. La grande variabilité observée des types d’éléments conducteurs (vaisseaux, trachéides, fibres…) entre espèces et familles, l’abondance et le diamètre de ces éléments a évidemment une influence sur le transfert de la sève brute. Ainsi, le transfert d’eau dans le bois d’aubier des arbres va différer selon ces grands types (voir aussi dans le Chap. IV.3) :
• Les bois à zone poreuse (chênes, châtaignier, robinier faux-acacia, orme, frêne, ..). Chez ces espèces, il existe dans chaque cerne un petit nombre de gros à très gros vaisseaux. L’essentiel du flux de sève brute se fait à travers eux. Seule une faible partie de la surface transversale du tronc, c’est-à-dire des cernes, est utilisée pour la conduction de la sève. En voici un exemple pour un chêne d’une quarantaine d’années d’un diamètre de 14 cm à 1,3 m de hauteur. En partant de l’extérieur vers le centre du tronc, on a montré, au moyen de mesures de flux de sève réalisées à différentes profondeurs (voir Fig. 42) que les 5 cernes les plus externes conduisaient environ 85% de la sève brute. Les 10 plus profonds conduisaient encore de la sève, mais avec une densité de flux moindre (15%). Enfin, la sève ne circulait pas dans les 25 cernes restants (le bois de cœur).
Dans cette expérimentation, une incision profonde a ensuite été pratiquée juste au-dessous du plan de mesure, interrompant le flux de sève dans les cernes les plus externes. Très rapidement (Fig. 43), une augmentation du flux de sève a été observée dans les 10 cernes auparavant peu actifs, qui ont pris le relais après l'annélation.
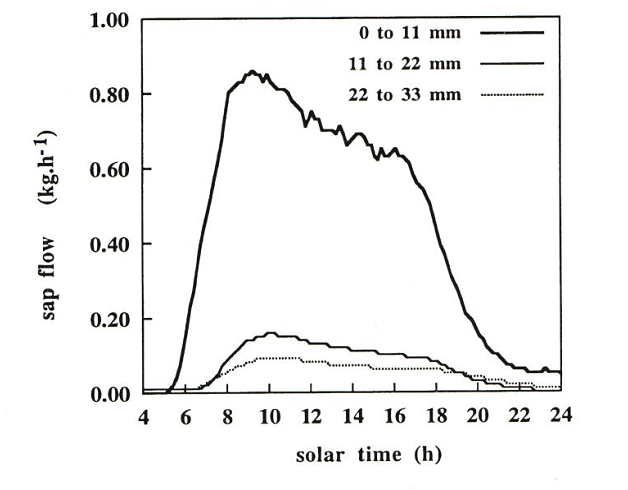
Figure 42. Variation journalière du flux de sève dans le tronc d’un chêne sessile mesuré à 3 profondeurs au moyen de capteurs de 11 mm de longueur (capteurs à dissipation thermique continue). Tiré de Granier et al. (1994).
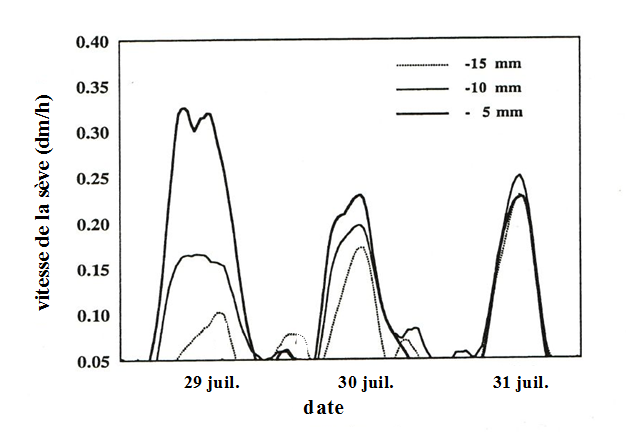
Figure 43. Effet d’une annélation provoquée des vaisseaux du bois d’aubier d’un chêne sessile sur la vitesse de circulation de la sève. Les mesures ont été réalisées à 3 profondeurs dans le tronc par la méthode des impulsions de chaleur. L’embolie a été provoquée à la fin du premier jour de mesure par annélation. Les deux journées suivantes montrent les conséquences sur la répartition du transfert de sève. Tiré de Granier et al. (1994).
• Dans les bois à pores diffus (hêtre, charme, peuplier, bouleau…), le bois d’aubier est souvent plus large que chez les espèces à zone poreuse. Des capteurs de flux positionnés à différentes profondeurs permettent de mesurer le gradient de densité de flux de sève. La figure 44 montre un exemple d’un tel profil établi dans de jeunes hêtres de 8 à 12 cm de diamètre. On constate que, malgré une certaine dispersion des données, ce profil est décroissant (la relation est sensiblement exponentielle). Sur ces jeunes arbres, un transfert de sève brute non négligeable est observé à proximité du centre de l’arbre.
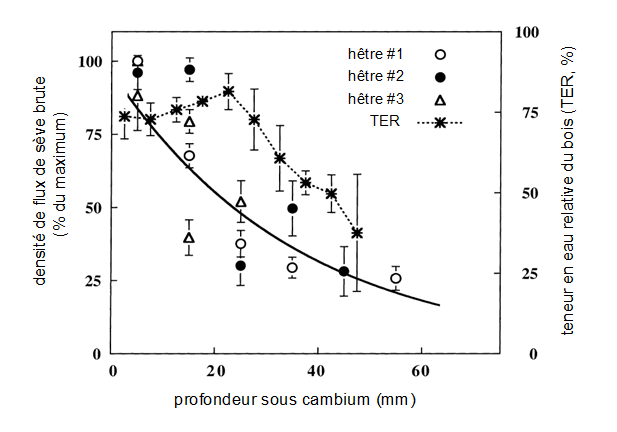
Figure 44. Variation radiale de la densité de flux de sève, exprimée en % de son maximum, en fonction de la profondeur du capteur sous l’écorce, dans 3 jeunes hêtres. La relation (ligne pleine) est ajustée sur l’ensemble des points expérimentaux. On a représenté sur ce graphique la variation radiale de la teneur en eau relative mesurée sur des carottes.
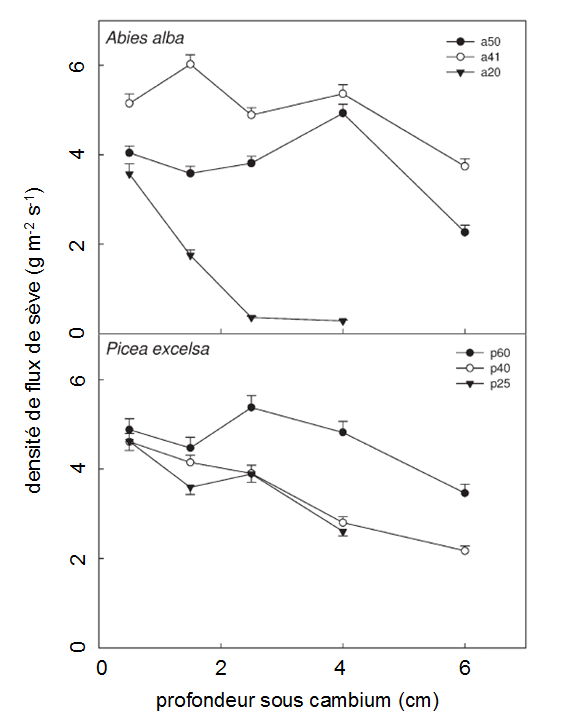
Figure 45. Variation radiale de la densité de flux de sève, chez deux espèces de conifères (Fiora et Cescatti, 2006).
• Enfin, chez les conifères (sapins, pins, épicéas, mélèzes…), dont le bois d’aubier est généralement large, on observe des profils de densité de flux plus aplatis. La décroissance avec la profondeur est plus graduelle. Dans plusieurs expérimentations, on observe même un plateau dans la zone la plus périphérique où le débit de sève est constant (Fig. 45).
5.3 Propriétés fonctionnelles du système conducteur xylémien
La complexité anatomique du système conducteur de la sève brute qui vient d’être présentée confère au système vasculaire trois caractéristiques fonctionnelles remarquables : l’intégration, la redondance et la compartimentation. Ces propriétés correspondent à la double exigence : i) pouvoir distribuer l’eau dans tous les organes de la plante qui en ont besoin ; ii) assurer une protection efficace contre les entrées d’air.
L’intégration et la redondance
Un grand nombre d’observations et d’expérimentations montre que dans la plupart des cas, le réseau vasculaire forme un ensemble dans lequel n’importe quelle racine est en relation avec n’importe quel organe aérien. Corrélativement, il existe toujours au moins un chemin entre une racine et une feuille, un fruit, ou un rameau donnés. Une observation courante va dans ce sens : quand une plante subit la sécheresse, très souvent toutes les feuilles sont flétries et non pas seulement une partie d’entre elles. Or, selon toute probabilité, les racines ne sont pas toutes dans une partie desséchée du sol. Cette intégration permet aux racines d’un horizon où l’eau est plus disponible que dans un autre de prendre le relais. Il y a des trajets de moindre résistance hydraulique entre telle partie du houppier et telle partie du système racinaire. Ce sont ceux qui sont utilisés en conditions de bonne alimentation hydrique. En cas d’hétérogénéité d’humidité du sol, la partie du système racinaire située dans la partie du sol la plus humide pourra alimenter des parties de la couronne qu’elle ne dessert pas en conditions normales[15], [16] (voir aussi Chap. II.3). En conditions contrôlées, des expérimentations dites de split-root[17], où un système racinaire est divisé latéralement dans deux compartiments portés à des niveaux d’humidité différents, démontrent cette capacité. De même, la course journalière du soleil sur le houppier d’un arbre fait que ce ne sont pas toujours les mêmes feuilles qui transpirent le plus. Il y, a grâce à cette intégration du réseau vasculaire une redistribution continuelle des flux entre racines et branches. Tous les trajets n’ont pas la même résistance, si bien qu’en cas de conditions de mauvaise alimentation en eau, le dessèchement (ou la réhydratation) des différentes parties de la couronne n’est pas la même partout : certaines zones se dessècheront (ou se réhydrateront) plus rapidement que d’autres. Une illustration de cette plasticité, facilement observable, est la capacité qu’a un arbre de survivre lorsqu’il n’est que partiellement déraciné. Si une partie suffisante de son système racinaire reste en place, l’arbre peut survivre (voir photo 2).

Photo 2. Un pin sylvestre renversé lors de la tempête de décembre 1999. Cette photo a été prise en Lorraine en 2010. Certaines branches latérales ont pris une direction verticale et l’allure de nouveaux houppiers.
• La redondance est une propriété proche de l’intégration ; elle traduit le fait que le long d’une tige ou d’une branche, la sève circule simultanément dans plusieurs vaisseaux qui sont des voies parallèles : si l’un est embolisé, d’autres restent fonctionnels. Tyree et al. 1995 ont montré que le même degré d’embolie dans deux arrangements différents de vaisseaux conduisait à des conséquences différentes.
• La macro et la micro compartimentation. Il y a cependant des exceptions à cette intégration fonctionnelle. C’est en particulier le cas chez de vieux arbres. Un cloisonnement progressif des différentes parties de l’arbre peut se mettre en place avec le temps. Cette détérioration progressive du réseau majeur des connexions vasculaires aboutit à une individualisation des différentes parties de l’arbre (Drénou, 1994). On l’appellera macro compartimentation.
A une autre échelle, celle des éléments conducteurs eux-mêmes, il existe une micro compartimentation qui peut être interprétée comme un dispositif de protection contre l’embolie. Celle-ci résulte du fait que chacune des extrémités d’un vaisseau ou d’une trachéide est fermée, du fait de la présence des ponctuations ou de plaques perforées : si un de ces éléments conducteurs est ouvert, par une blessure par exemple, il va se vider. Toutefois cette rétraction de l’eau va être stoppée grâce aux ponctuations. Celles-ci agissent comme de minuscules grilles qui stoppent le retrait de l’eau à leur niveau. Sans elles, l’embolie d’un vaisseau entrainerait celle de tous les vaisseaux qui lui sont connectés. C’est en ce sens que la présence des ponctuations « compartimente » le réseau vasculaire au niveau de chaque élément conducteur (voir Chap. II.7) et limite la propagation de l’embolie.
[1] Drénou C (2006) Les racines, face cachée des arbres. Editions IDF, Paris, 335p.
[2] Dupraz C, Liagre F (2008) Agroforesterie, des arbres et des cultures. Editions France Agricole, 414p.
[3] Les mycorhizes sont des formations constituées par l’association d’un champignon et les tissus du cortex racinaire. Elles sont présentes chez un grand nombre de plantes et en particulier chez les arbres : elles y jouent un rôle essentiel dans l’absorption d’un grand nombre d’éléments et de l’eau
[4] Sur www.snv.jussieu.fr/bmedia/racine/07-poils.htm on peut voir deux belles séquences vidéo de croissance de poils absorbants ainsi qu’un cours sur la structure et la croissance des racines.
[5] Kramer PJ (1969) Plant and soil water relationships: a modern synthesis. New York, USA. McGraw-Hill Book Company.
[6] Les poils absorbants se développent aussi très bien en atmosphère quasiment saturée à température moyenne (20°C)
[7] Cette humidité correspond à l’humidité maximale d’un sol ressuyé. En fait les poils absorbants peuvent avoir un développement considérable en atmosphère très humide proche de la saturation, et avec une température suffisante (20-30 °C).
[8] Cailloux M (1962) Metabolism and the absorption of water by root hairs. Can. J. Bot. 50 (3), 557-573
[9] Jones HG (1983) Estimation of an effective soil water potential… Plant Cell Environ., 6 (8), 671-674.
[10] Meidner H, Sheriff D (1976) Water and Plants, Blackie, 148p.
[11] Kramer PJ (1983) Water Relations of Plants. Academic Press, 489p.
[12] Kramer PJ, Boyer JS (1995) Water relations of Plants and Soils. Academic Press, 495p.
[13] Peterson CA, Enstone DE (1996) Functions of passage cells in the endodermis and exodermis of roots. Physiol. Plant. 97, 592-598
[14] Rudinsky JA, J. P. Vité JP (1959) Certain ecological and phylogenetic aspects of the pattern of water conduction in conifers. For. Sci., 5(3), 259–266.
[15] Aussenac G, Granier A, Ibrahim M (1984) Influence du dessèchement du sol sur le fonctionnement hydrique et la croissance du Douglas (Pseudotsuga menziesii (Mirb.) Franco). Acta Œcologica, Œcologia Plantarum, 5 (19), 241-253.
[16] Simmoneau T (1992) Absorption d’eau en conditions d’alimentation hydrique non uniforme. Thèse INA-PG, Paris 239p + annexes
[17] Voir en particulier Davies WJ et Bacon MA (2003) Adaptation of roots to drought. Root ecology. Springer, Berlin, Heidelberg, 173-192.
Sommaire :
- I. OUTILS ET CONCEPTS DE BASE
- II. ETATS ET TRANSFERTS HYDRIQUES DANS ET À TRAVERS LA PLANTE
- II.1. La cellule en tant que compartiment hydrique
- Introduction : la cellule végétale vivante
- Le potentiel hydrique de la cellule et ses composantes.
- Relation potentiel hydrique – volume cellulaire : le diagramme de Höfler
- L’osmorégulation
- Les transferts d’eau transmembranaires
- Importance des relations hydriques pour l’expansion cellulaire
- Mesure des composantes du potentiel hydrique cellulaire
- Références bibliographiques
- II.2. Anatomie des voies de transfert de l’eau dans la plante
- II.3. L'eau dans les tissus et les organes de la plante et ses méthodes de caractérisation
- II.4. L’absorption de l'eau du sol par les racines
- II.5. La transpiration foliaire
- II.6. Transferts et états hydriques dans le continuum Sol-Plante-Atmosphère
- II.7. L’architecture hydraulique, la cavitation et l’embolie des plantes
- II.8. Un modèle simple de fonctionnement hydrique à l'échelle de la plante entière. Application pour un arbre
- II.9. Les flux de sève dans la plante : couplage entre xylème et phloème, modélisation
- II.10. L’eau et le métabolisme carboné : C3/C4, CAM ; efficience de l’eau
- II.1. La cellule en tant que compartiment hydrique
- III. FONCTIONNEMENT DES VEGETAUX EN SITUATION DE STRESS LIE A L’EAU
- III.1. Les végétaux face à la sécheresse
- III.2. Efficience agronomique de l’eau
- Les composantes de l’efficience d’utilisation de l’eau par les cultures.
- Nécessité de quantifier séparément Evaporation du sol et Transpiration des plantes
- Les interactions entre nutrition azotée et alimentation hydrique, conséquence sur l’efficience d’utilisation de l’eau par les cultures.
- Références bibliographiques
- IV. AGRONOMIE DE L’EAU





