Le potentiel hydrique de la cellule et ses composantes.
A l’échelle de la plante, le potentiel hydrique d’un organe est une grandeur physique qui décrit son statut hydrique, c’est-à-dire, s’il est déshydraté ou non. Le potentiel hydrique d’un organe dépend de l’humidité du sol et donc de son potentiel hydrique, du taux de transpiration de la plante, et des résistances hydrauliques sur le parcours sol-plante-atmosphère. Le potentiel hydrique d’un organe reflète le potentiel hydrique des cellules qui le composent.
Défini thermodynamiquement, le potentiel hydrique d’un système comporte 3 composantes :
Y = YP + Yp + Yg (éq. 1)
A l’échelle de la cellule (quelques dizaines de microns), la composante gravitationnelle Yg peut être négligée (1 bar, soit 0.1 MPa pour 10 mètres de dénivelé). Ainsi, le potentiel hydrique cellulaire dépend essentiellement de deux paramètres, YP, le potentiel hydrostatique ou pression de turgescence, et YP, le potentiel osmotique :
Y = YP + Yp (éq. 2)
Le potentiel hydrostatique YP dans la cellule, aussi appelé pression de turgescence (souvent notée P), représente la pression hydrostatique dans la cellule. L’existence de cette pression est possible parce que la membrane plasmique est entourée d’une paroi pectocellulosique qui résiste à cette pression et ainsi empêche la membrane plasmique d’exploser sous la pression. La paroi est indispensable car les cellules végétales vivent très souvent dans un milieu hypotonique[1].
La pression de turgescence P varie dans les cellules végétales en fonction de l’organe, du type de cellules et des conditions environnementales où vit la plante. Sa gamme s’étend de quelques bars (typiquement 4-6 bar, soit 0,4-0,6 MPa pour des cellules de racines) à 15-20 bars (1,5 – 2 MPa) dans les cellules épidermiques de feuilles. Pour comparaison, la pression dans les pneus d’une voiture est en général de 2 à 3 bars maximum.
Le potentiel osmotique Yp de la cellule est, par convention, égal à l’opposé de la pression osmotique P du contenu cellulaire. Il reflète les interactions entre les molécules d’eau et leur environnement, c’est-à-dire les solutés dissous d’une part et les surfaces des macromolécules d’autre part.
La pression osmotique P d’une solution est définie ainsi :
P = -RT/Vw . ln (aw) (éq. 3)
où R st la constante des gaz parfait, T la température en Kelvin, Vw le volume molal[2] partiel de l’eau et aw l’activité de l’eau[3] (voir Chapitre I.2).
Si on considère que l’activité de l’eau aw est égale à gw . Nw, où gw est le coefficient d’activité de l’eau et Nw la fraction molaire de l’eau dans la solution considérée, on met à jour ainsi les deux composantes de ce potentiel osmotique :
P = - RT/Vw . ln (gw . Nw)
P = - RT/Vw . ln (gw) - RT/Vw . ln (Nw)
Le premier terme traduit les effets des interactions entre l’eau et les colloïdes (particules solides allant d’environ de 2 nm à 1 µm, suspendues dans la phase aqueuse, par exemple les protéines, les ribosomes) au sein du cytosol. Les molécules d’eau sont liées par des forces matricielles et donc moins disponibles pour les réactions chimiques ou pour s’évaporer. Hormis quelques cas particuliers (lors de l’imbibition des graines par exemple), la contribution de ces forces matricielles (le potentiel matriciel) au potentiel hydrique est très faible devant celle due aux solutés dissous (cf. ci-dessous). Cette composante est de ce fait négligée.
Le deuxième terme est lié à la pression osmotique développée par les solutés dissous dans le cytosol, c'est-à-dire la pression qui serait développée par le cytosol dans un osmomètre (voir chapitre I.2). Sous quelques approximations raisonnables (les concentrations cj des différents solutés présents dans le cytosol sont faibles), la pression osmotique d’une solution est proportionnelle à sa concentration en différents solutés (c’est la loi de Van t’Hoff), soit :
P = - RT/Vw . ln (Nw)
sachant que :
Nw = nw / ( nw + Snj) = 1 - Snj / (nw + Snj) ≈ 1 - Snj / nw
et que :
ln(Nw) ≈ ln (1 - Snj/ nw) ≈ Snj / nw
on obtient :
P ≈ - RT/Vw . Snj / nw≈ -RT . Scj (éq. 4)
avec :
nj et nw respectivement le nombre de moles du soluté j et d’eau ;
cj la concentration du soluté j.
Comme pour la pression de turgescence, la pression osmotique d’une cellule végétale dépend du type cellulaire et de l’environnement mais aussi de l’espèce. Les cellules des espèces de milieu sec ont une pression osmotique plus grande que celle des espèces mésophiles. Le centre de la gamme de variation est de 1 à 3 MPa, soit 10 à 30 bars.
En résumé, le potentiel hydrique d’une cellule est égal à la différence entre la pression de turgescence P et la pression osmotique P du contenu cellulaire (voir aussi chapitre I.2). La paroi pectocellulosique qui entoure le protoplaste résiste à la pression de turgescence en exerçant une pression opposée. La pression osmotique est due aux solutés dissous, elle dépendra du niveau d’hydratation de la cellule et de procédés actifs régulant le contenu en solutés dissous (cf. § II.1.4).
Y = P - P (éq. 5)
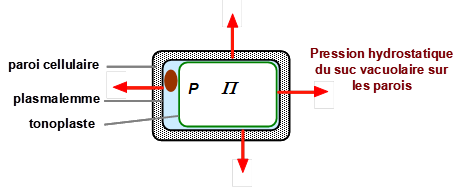
Figure 2. Schéma simplifié de la cellule végétale : forces de pression hydrostatique s’exerçant sur sa paroi.
Le potentiel hydrique cellulaire qualifie l’état hydrique de la cellule. Il est négatif ou nul. Plus il est négatif, plus la cellule est déshydratée. La plupart du temps, le potentiel hydrique cellulaire est en équilibre avec son environnement direct, l’apoplasme. En cas de déséquilibre, le gradient entre le potentiel hydrique de la cellule et celui de son environnement détermine la force motrice des flux d’eau entrant ou sortant de ce système (cf. § II.1.5).
Sommaire :
- I. OUTILS ET CONCEPTS DE BASE
- II. ETATS ET TRANSFERTS HYDRIQUES DANS ET À TRAVERS LA PLANTE
- II.1. La cellule en tant que compartiment hydrique
- Introduction : la cellule végétale vivante
- Le potentiel hydrique de la cellule et ses composantes.
- Relation potentiel hydrique – volume cellulaire : le diagramme de Höfler
- L’osmorégulation
- Les transferts d’eau transmembranaires
- Importance des relations hydriques pour l’expansion cellulaire
- Mesure des composantes du potentiel hydrique cellulaire
- Références bibliographiques
- II.2. Anatomie des voies de transfert de l’eau dans la plante
- II.3. L'eau dans les tissus et les organes de la plante et ses méthodes de caractérisation
- II.4. L’absorption de l'eau du sol par les racines
- II.5. La transpiration foliaire
- II.6. Transferts et états hydriques dans le continuum Sol-Plante-Atmosphère
- II.7. L’architecture hydraulique, la cavitation et l’embolie des plantes
- II.8. Un modèle simple de fonctionnement hydrique à l'échelle de la plante entière. Application pour un arbre
- II.9. Les flux de sève dans la plante : couplage entre xylème et phloème, modélisation
- II.10. L’eau et le métabolisme carboné : C3/C4, CAM ; efficience de l’eau
- II.1. La cellule en tant que compartiment hydrique
- III. FONCTIONNEMENT DES VEGETAUX EN SITUATION DE STRESS LIE A L’EAU
- III.1. Les végétaux face à la sécheresse
- III.2. Efficience agronomique de l’eau
- Les composantes de l’efficience d’utilisation de l’eau par les cultures.
- Nécessité de quantifier séparément Evaporation du sol et Transpiration des plantes
- Les interactions entre nutrition azotée et alimentation hydrique, conséquence sur l’efficience d’utilisation de l’eau par les cultures.
- Références bibliographiques
- IV. AGRONOMIE DE L’EAU
Dans le chapitre :
- Introduction : la cellule végétale vivan...
- Le potentiel hydrique de la cellule et s...
- Relation potentiel hydrique – volume cel...
- L’osmorégulation
- Les transferts d’eau transmembranaires
- Importance des relations hydriques pour ...
- Mesure des composantes du potentiel hydr...
- Références bibliographiques





