Relation potentiel hydrique – volume cellulaire : le diagramme de Höfler
Le potentiel hydrique de chaque cellule végétale s’ajuste constamment aux variations du potentiel hydrique de son environnement, c’est-à-dire de l’apoplasme. Le potentiel hydrique de l’apoplasme dépend de sa composante osmotique, de sa composante matricielle et de sa pression hydrostatique. Alors que la pression hydrostatique dans l’apoplasme des cellules en contact direct avec l’atmosphère est nulle (car la pression atmosphérique est la référence), une certaine pression, positive ou négative peut se développer dans l’apoplasme des cellules adjacentes au xylème (Cf. chapitre II.6).
Les membranes cellulaires sont perméables à l’eau (cf. § II.1.3) et dès que le potentiel hydrique du milieu extérieur à la cellule varie, un flux d’eau entrant ou sortant de la cellule se produit, affectant le volume de la cellule et son potentiel hydrique. Ce flux conduit à un retour à l’équilibre des potentiels hydriques entre intérieur et extérieur de la cellule. Cependant la paroi cellulaire limite sérieusement ces variations du volume cellulaire. Ainsi les variations du potentiel hydrique « extérieur » qui peuvent être très importantes (dues à la transpiration foliaire par exemple), sont accompagnées par de grande variations de pression de turgescence mais de faibles variations du volume du protoplaste.
Les relations entre le potentiel hydrique cellulaire, ses composantes et le volume cellulaire peuvent être décrites par un diagramme de Höfler (Fig. 3).
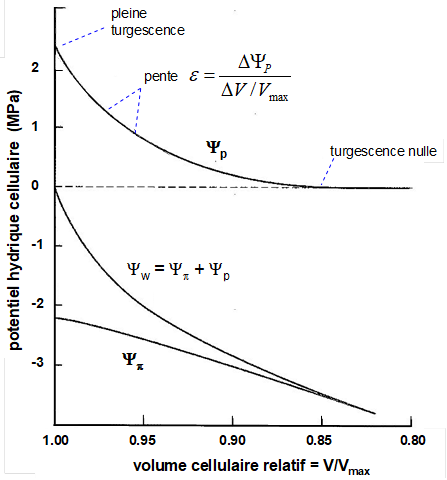
Figure 3. Le diagramme de Höfler établi sur une feuille végétale. La partie du haut montre la diminution du potentiel de turgescence (Yp) en fonction de celle du volume cellulaire relatif (V/Vmax). A un certain niveau de dessèchement, ce potentiel Yp s’annule. En bas de la figure, on voit, avec la diminution du volume cellulaire relatif celle du potentiel osmotique (Yp) et du potentiel hydrique total (Yw) qui est la somme algébrique des composantes de turgescence et osmotique (voir texte).
A l’état d’hydratation maximale, Y est nul : P compense pleinement la pression osmotique, la cellule est dite à « pleine turgescence ». Lorsque Y diminue (en abaissant le potentiel hydrique extérieur de la cellule), P diminue de concert alors que P est beaucoup moins affecté (le volume d’eau sortant est faible par rapport au volume total, augmentant peu la concentration en solutés). Lorsque le potentiel hydrique cellulaire est diminué à -2 MPa, P est abaissé de 1.5 MPa alors que le volume cellulaire n’est diminué que de 5%. Cette faible déshydratation induit seulement une petite augmentation de la pression osmotique P.
Cette phase initiale où P chute fortement pour une faible variation du volume relatif, est suivie d’une phase où P diminue moins vite pour une même variation de volume. Lorsque P s’annule, on parle de plasmolyse : le protoplaste n’exerce plus de pression sur la paroi cellulaire. En général, La plasmolyse se produit pour une perte de volume relatif de 10 à 15%. Au-delà, la diminution du potentiel hydrique Y est entièrement dû à la déshydratation de la cellule et donc à la chute du potentiel osmotique (augmentation de la pression osmotique due à la concentration des solutés).
Le diagramme de Höfler est théoriquement susceptible de s’appliquer à la majorité des types cellulaires. C’est un outil de base pour étudier les variations concomitantes du potentiel hydrique et du volume cellulaire. Notons que ce modèle ne s’applique que si la membrane plasmique est supposée hémiperméable : les variations de Y sont dues à des variations de volume (dues à des flux d’eau) et non pas à des flux de solutés ou des variations internes de la concentration en solutés (c’est-à dire un ajustement osmotique, cf. ci-dessous § II.1.3). La perméabilité des membranes à l’eau est supérieure de plusieurs ordres de grandeur à la perméabilité aux ions et petites molécules, l’approximation de l’hémiperméabilité est valable dans un grand nombre de cas. D’autre part, ce modèle ne concerne que les cellules matures, dont la paroi n’est plus plastique (déformable de façon irréversible) mais seulement élastique, déformable de façon réversible. Moyennant certaines hypothèses, ce modèle peut être transposé à l’échelle de l’organe, notamment la feuille, et ainsi donner accès à ses propriétés hydriques.
La relation entre la variation de P et celle du volume cellulaire relatif donne accès à un paramètre important, le module d’élasticité cellulaire e :
e = dP/(dV/V)
soit : dP= e (dV/V) (éq. 6)
Ainsi, plus e est grand, plus les parois cellulaires sont rigides, peu déformables : pour un changement donné de volume, la variation de pression sera d’autant plus grande que e est grand. Sur le diagramme d’Höfler, e correspond à la pente entre P et le volume relatif (voir Fig. 3), pente qui varie avec le dessèchement de la cellule. Ainsi, pour une même cellule, e varie avec sa pression de turgescence et son volume relatif : plus la turgescence est forte, plus e est grand ; lorsque que la cellule est proche de la plasmolyse, e devient très faible.
Par ailleurs, e varie fortement entre espèces. Ainsi, chez les algues géantes à pleine turgescence, e varie de 20 à plus de 100 MPa. Chez les cellules de plantes supérieures, e est plus faible, autour de 1 à 10 MPa. Par exemple, e a été estimé à 0,7, 1,5 et 10 MPa chez le tournesol, le maïs et une variété de platane, respectivement.
Par ailleurs, e varie fortement d’un type cellulaire à l’autre au sein d’une même espèce. Au sein d’un même organisme, les cellules sont spécialisées pour différentes fonctions. Les propriétés des parois peuvent contribuer à cette spécialisation. Chez les cactées, les tiges sont dites succulentes : une couche de cellules photosynthétiques entoure un cortex de cellules non photosynthétiques servant de réservoir d’eau. Lorsque la plante est soumise à une sécheresse, toutes les cellules sont soumises à un même potentiel hydrique bas, mais ces cellules internes, qui présentent un module d’élasticité bien plus faible que les cellules périphériques (les parois sont plus fines et flexibles), vont perdre plus d’eau et contribuer à maintenir une meilleure hydratation des cellules photosynthétiques.e 1000 g.
Sommaire :
- I. OUTILS ET CONCEPTS DE BASE
- II. ETATS ET TRANSFERTS HYDRIQUES DANS ET À TRAVERS LA PLANTE
- II.1. La cellule en tant que compartiment hydrique
- Introduction : la cellule végétale vivante
- Le potentiel hydrique de la cellule et ses composantes.
- Relation potentiel hydrique – volume cellulaire : le diagramme de Höfler
- L’osmorégulation
- Les transferts d’eau transmembranaires
- Importance des relations hydriques pour l’expansion cellulaire
- Mesure des composantes du potentiel hydrique cellulaire
- Références bibliographiques
- II.2. Anatomie des voies de transfert de l’eau dans la plante
- II.3. L'eau dans les tissus et les organes de la plante et ses méthodes de caractérisation
- II.4. L’absorption de l'eau du sol par les racines
- II.5. La transpiration foliaire
- II.6. Transferts et états hydriques dans le continuum Sol-Plante-Atmosphère
- II.7. L’architecture hydraulique, la cavitation et l’embolie des plantes
- II.8. Un modèle simple de fonctionnement hydrique à l'échelle de la plante entière. Application pour un arbre
- II.9. Les flux de sève dans la plante : couplage entre xylème et phloème, modélisation
- II.10. L’eau et le métabolisme carboné : C3/C4, CAM ; efficience de l’eau
- II.1. La cellule en tant que compartiment hydrique
- III. FONCTIONNEMENT DES VEGETAUX EN SITUATION DE STRESS LIE A L’EAU
- III.1. Les végétaux face à la sécheresse
- III.2. Efficience agronomique de l’eau
- Les composantes de l’efficience d’utilisation de l’eau par les cultures.
- Nécessité de quantifier séparément Evaporation du sol et Transpiration des plantes
- Les interactions entre nutrition azotée et alimentation hydrique, conséquence sur l’efficience d’utilisation de l’eau par les cultures.
- Références bibliographiques
- IV. AGRONOMIE DE L’EAU
Dans le chapitre :
- Introduction : la cellule végétale vivan...
- Le potentiel hydrique de la cellule et s...
- Relation potentiel hydrique – volume cel...
- L’osmorégulation
- Les transferts d’eau transmembranaires
- Importance des relations hydriques pour ...
- Mesure des composantes du potentiel hydr...
- Références bibliographiques





