Variations de l’état hydrique d’une plante : teneur en eau et potentiel hydrique
Les valeurs de teneur en eau présentées dans le tableau 1 sont des ordres de grandeur. En réalité, la teneur en eau de la plante est soumise à des variations à différentes échelles de temps, que ce soit au cours d’une journée ou d’une saison. Certaines de ces variations ont un caractère intrinsèque, étant liées à la phénologie de l’espèce. Une céréale annuelle, par exemple, voit sa teneur en eau augmenter à la levée des jeunes pousses, puis se stabiliser lorsqu’elle aura atteint un certain stade de développement, et enfin chuter lors de la maturation des grains.
Mais au-delà de l’influence de l’état phénologique de la plante, la contrainte hydrique, liée tant au climat qu’à la disponibilité en eau du sol, exerce une contrainte forte sur les tissus de la plante. Dans cette partie, nous présenterons des exemples issus d’expérimentations d’écophysiologie illustrant les variations de teneur en eau de la plante ou de ses organes, ainsi que celles de son potentiel hydrique.
4.1 Variations nycthémérales [2]
Au cours d’une journée, tout particulièrement lorsqu’elle est ensoleillée et chaude, certains tissus de la plante montrent des variations de teneur en eau. La plante, dans son milieu naturel, est fréquemment soumise à des variations, parfois brusques, de la demande transpiratoire. Ces variations entrainent celles de sa transpiration, de son potentiel hydrique (voir chapitre II.6) mais aussi de sa teneur en eau. Il est possible de mettre en évidence ces variations au moyen de plusieurs approches, soit en réalisant des mesures directes, soit des mesures indirectes. En effet, les déshydratations et réhydratations des organes de la plante peuvent se manifester par des variations géométriques, par exemple l’angle des feuilles sur les tiges, ou bien les dimensions des organes, leur circonférence ou leur rayon. Les méthodes de mesure seront détaillées un peu plus loin dans ce chapitre.
Nous présentons ici (Fig. 6) quelques exemples de variations nycthémérales mesurées sur des pommiers dans un verger, celles du diamètre de tiges et celles de fruits. On observe des variations cycliques, clairement en phase avec celles du rayonnement solaire incident. Ces organes atteignent leur maximum de dimension (dilatation) en fin de nuit et leur minimum (contraction) en début d’après-midi. On met aussi en évidence sur cette figure la croissance, très visible d’une journée à l’autre, les deux phénomènes se superposant.
[2] alternance d'un jour et d'une nuit correspondant à un cycle biologique de 24 heures
Sur la Fig.7, les variations de teneur en eau des feuilles sont appréhendées au moyen de la mesure de leur épaisseur. En effet, il existe une relation linéaire entre l’épaisseur de la feuille et sa TER (Fig. 7, gauche).
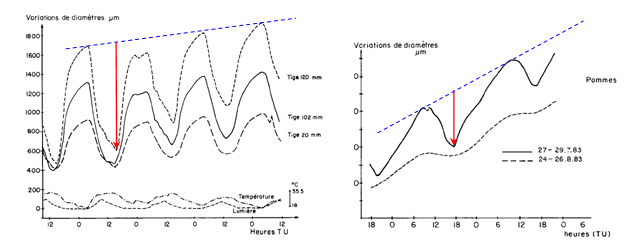

Figure 6. Variations du diamètre de tiges de pommiers de différents diamètres (à gauche) et d’un fruit (à droite), au mois de juillet et d’août, lors d’une succession de quelques journées. La figure de gauche montre aussi les variations de la température de l’air et celles du rayonnement solaire. L’examen de ces figures montre la superposition de deux phénomènes : d’une journée à la suivante, on peut voir la croissance de la branche ou du fruit (traits pointillés bleus), alors que sur une période de 24 heures on met en évidence un cycle qui débute par une contraction (flèches rouges) suivie d’une dilatation. D’après Huguet et al. (1985).
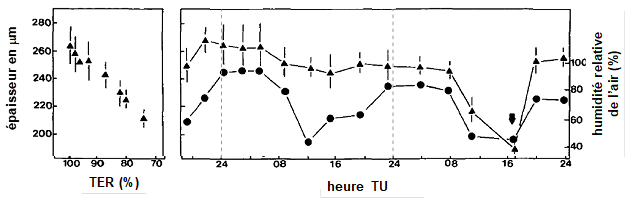
Figure 7. A droite : variations de l’épaisseur (triangles noirs) d’une feuille de colza (Brassica napus) en fonction du temps, lors de deux journées successives. Les variations de l’humidité relative de l’air sont aussi représentées (ronds noirs). La petite figure de gauche montre la relation linéaire entre l’épaisseur de la feuille et sa teneur en eau relative. Cette étroite relation permet de passer facilement de la mesure de l’épaisseur des feuilles à leur teneur en eau de façon non destructrice. Repris de Burquez (1987).
Des mesures peuvent porter directement sur le contenu en eau des organes lorsqu’on dispose de capteurs adaptés. De telles mesures sont plus aisées à mettre en œuvre sur des arbres que sur des végétaux de petite dimension, de type herbacé par exemple. De telles mesures ont été réalisées dans le tronc de hêtres en forêt avec des capteurs d’humidité utilisés normalement dans le sol (Fig. 8). Cette figure montre clairement des variations, similaires à celles de la Fig. 6, en phase avec celles du rayonnement solaire, mais de sens opposé.

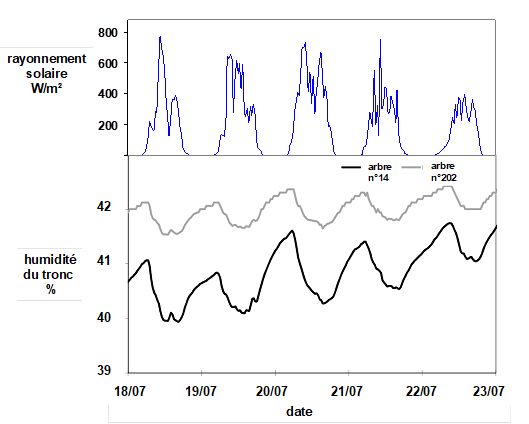
Figure 8. Variations de l’humidité du tronc de deux hêtres dans une parcelle expérimentale de la forêt de Hesse (Moselle). Les mesures ont été réalisées au moyen d’une sonde comportant 4 électrodes enfoncées dans la zone externe du bois sur quelques cm de profondeur (voir dans le petit cadre une photo de ce capteur). D’après Betsch (2010).
4.2. Variations saisonnières
Certaines des variations de teneur en eau des plantes sont directement liées à leur cycle phénologique. Ce phénomène est particulièrement clair pour nombre de cultures (céréales, colza par exemple), riches en eau pendant la phase de croissance active au printemps, puis se desséchant en été pendant la maturation des grains. Ce cycle annuel est clairement visible (Fig. 9) sur une plante pluriannuelle à rhizome, le miscanthus, cultivé à des fins énergétiques. La teneur en eau est ici maximale au mois de juin (Te > 80%), puis diminue de façon importante à partir du mois de septembre, pour descendre en hiver à des valeurs de l’ordre de 30 à 40%. C’est à cette période que ces plantes sont récoltées.

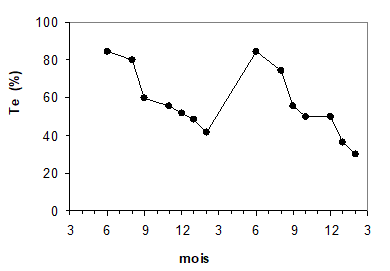
Figure 9. Variations de la teneur en eau de plants de Miscanthus sinensis ‘Giganteus’, dont une culture est représentée sur la photo de droite, au cours de deux années successives. D’après Schwarz et al. (1994).
Au-delà de ces variations saisonnières naturelles, la sécheresse a un impact déterminant, à la fois sur la teneur en eau des plantes et sur leur transpiration (voir les Chap. II.5 et II.6). En conditions naturelles, des sécheresses peuvent s’installer sur des durées importantes dans beaucoup de régions, soumettant les plantes à des contraintes prolongées, particulièrement les arbres qui ne sont que très rarement irrigués.
Avec la mesure du potentiel de base, il est possible de mettre en évidence et de quantifier l’intensité des périodes de dessèchement du sol à travers leur effet sur l’état hydrique de la plante. La Fig. 10 présente un exemple de mesures périodiques de potentiel de base réalisées sur des épicéas en moyenne montagne. Dans cette expérimentation, un groupe d’arbres a été soumis à un dessèchement au moyen d’une toiture évacuant les pluies. Un second groupe d’arbres à proximité immédiate a été maintenu dans des conditions de bonne humidité du sol par irrigation. On constate qu’au début de la période de mesure, avant la mise en place du toit, les potentiels de base des deux groupes d’arbres étaient voisins, proches de -0,5 MPa. Après l’installation du système de suppression des pluies, on observe un écart croissant du potentiel de base entre les deux traitements, atteignant environ 0,6 MPa au plus fort du dessèchement.
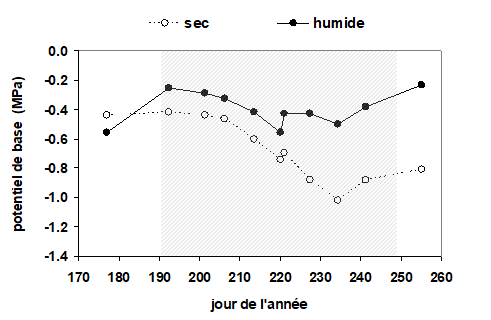
Figure 10. Evolution du potentiel de base mesuré au cours d’une période estivale (du 22 juin au 12 septembre) sur des rameaux d’épicéas (Picea abies) âgés d’environ 30 ans, dans les Vosges. Cette expérimentation comportait deux traitements : un groupe d’arbres subissant un dessèchement (cercles), provoqué artificiellement en supprimant la pluie au sol, grâce à une toiture formée de plaques en matière plastique, disposées à 2 m au-dessus du sol, au-travers desquelles passaient les troncs. De plus, pour éviter l’influence de transferts latéraux intempestifs dans le sol, une tranchée a été creusée autour de ce groupe d’arbres. Le second traitement (ronds noirs) était constitué d’arbres de dimensions identiques situés à proximité, maintenus bien alimentés en eau par irrigation. La zone grisée représente la période où la toiture était en place (10 juillet au 7 septembre). Chaque mesure est la moyenne de 4 arbres.
Si le potentiel hydrique de la plante s’équilibre la nuit avec celui du sol, on peut se poser la question de la localisation des zones du sol où cet équilibre se produit lorsque le sol est desséché ? La Fig. 11 en donne une réponse, dans une expérimentation réalisée en forêt, où des sapins de Douglas étaient soumis à une sécheresse, par suppression des pluies sur une période estivale de plus de deux mois. Le potentiel hydrique du sol a été mesuré chaque jour à 3 niveaux de profondeur dans le sol au moyen de micropsychromètres. Parallèlement, le potentiel de base a été mesuré tous les 10 jours environ, au moyen d’une chambre à pression sur des petits rameaux prélevés dans la couronne des arbres étudiés. Ces deux mesures ont été confrontées. Il est apparu qu’au début du dessèchement, le potentiel de base était en équilibre avec celui du sol mesuré à 30 cm de profondeur. Lorsque le dessèchement a progressé, c’est au niveau 60 cm que cet équilibre était réalisé. A la fin de la période de mesure (fin août sur la figure), il semble que l’équilibre de potentiel hydrique se réalisait avec un niveau plus profond dans le sol. On conclut de ces résultats que le potentiel de base de la plante s’équilibre avec les couches du sol à la fois les plus humides et les mieux colonisées par les racines fines de sol : d’abord les niveaux superficiels, puis au fur et à mesure de leur dessèchement, celles des niveaux inférieurs.
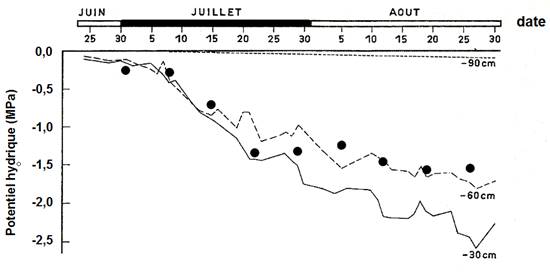
Figure 11. Evolution du potentiel hydrique du sol et du potentiel de base (·) de Douglas (Pseudotsuga menziesii) au cours d’une période de dessèchement. Le potentiel hydrique du sol était mesuré au moyen de micropsychromètres insérés à trois profondeurs, indiquées sur le graphique. Aussenac et al. (1984).
Chez beaucoup de plantes, la conséquence directe de la décroissance de leur potentiel hydrique est la diminution de la teneur en eau de la plupart de leurs organes vivants. A ce sujet, des auteurs (Waring et Running, 1978) ont réalisé une intéressante étude sur des sapins de Douglas (Pseudotsuga menziesii), conifères du nord-ouest américain maintenant largement utilisés en Europe. Les auteurs ont réalisé un suivi de la teneur en eau relative du bois d’aubier d’un ensemble d’arbres sur presque deux années, à partir de carottes extraites des troncs tout au long de l’expérience. Ramenés au laboratoire, les échantillons ont été pesés puis portés à saturation et pesés à nouveau. Après passage dans une étuve, le poids sec a été déterminé. Ces mesures permettent de calculer la teneur en eau relative (TER, voir ci-dessus), qui est égale à 100% à pleine saturation. On constate sur la Fig. 12 qu’en été, le bois d’aubier se dessèche, TER diminuant jusqu’à des valeurs de l’ordre de 50%. Cela signifie qu’à ce moment (entre les jours 180 et 210 pour l’année 1975), le bois d’aubier des arbres avait perdu la moitié de son contenu en eau. On observe aussi qu’en automne et en hiver, le bois d’aubier se réhydratait progressivement pour parvenir à sa pleine saturation en fin d’hiver (les jours 35 à 75 de l’année 1976). Au niveau quantitatif, les auteurs de cette étude ont évalué l’apport d’eau de ce réservoir complémentaire, localisé essentiellement dans le xylème, à 27 mm d'équivalent pluie.
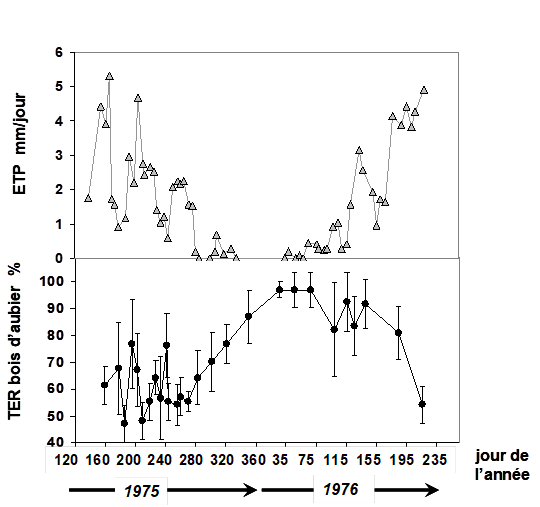
Figure 12. Variations de la teneur en eau relative du bois d’aubier (TER, sur la figure du bas) d’un vieux peuplement de Douglas (Pseudotsuga menziesii) situé en Oregon (côte ouest des USA) au cours de deux années de mesures, entre le printemps 1975 et le milieu de l’été 1976. La valeur 100% signifie que le bois d’aubier atteint son maximum possible de teneur en eau. Les mesures ont été réalisées sur des carottes prélevées dans le tronc de 5 à 10 arbres, chaque semaine en été (l’intervalle de temps était plus long en hiver). Les barres verticales représentent l’erreur standard sur la mesure. En haut est représentée l’évolution, sur la même période, de l’évapotranspiration potentielle (ETP), qui correspond à la demande climatique (voir chapitre II.6). L’ETP est ici est la moyenne des 5 jours précédant les prélèvements de carottes. Figure réalisée à partir de l’article de Waring et Running (1978).
L’appareil foliaire, feuilles ou aiguilles des arbres, est lui aussi le siège de variations de teneur en eau. Ce phénomène est bien connu, car très facile à observer sur une plante qui manque d’eau. La diminution de la teneur en eau des feuilles provoque la perte de leur rigidité, elles fanent et pendent vers le bas. Les feuilles d’arbres en conditions naturelles soumis à une sécheresse intense et prolongée, finissent par jaunir ou par brunir et parfois tombent chez certaines espèces. Les photos 1, qui ont été prises dans une forêt de hêtres lors d’un été exceptionnellement sec, illustrent ce phénomène accidentel.

 |
Photo 1. Deux vues de la couronne d’un hêtre en forêt domaniale de Hesse (Moselle), photographiée depuis une plateforme installée en hauteur. La photo de gauche a été prise le 13 juillet 2015, celle de droite le 21 août de la même année, au cours d’une forte sécheresse du sol. Le brunissement des feuilles, prononcé sur la photo de droite, est la conséquence du dessèchement précoce des feuilles, qui, normalement, n’intervient pas avant le mois d’octobre.
4.3. Où sont localisés ces réservoirs d’eau dans la plante ?
Les exemples présentés précédemment montrent l’importance du volume d’eau que peuvent représenter ces réservoirs d’eau dans une plante, particulièrement dans un arbre. Si le trajet de l’eau dans une plante est connu depuis longtemps, les échanges hydriques entre les tissus conducteurs de la sève brute et ces réservoirs, susceptibles de céder ou de récupérer de l’eau lorsque les contraintes hydriques augmentent, le sont en revanche moins.
Dans une plante, il y a rarement indépendance entre ses différents tissus qui présentent des connexions entre eux, donc des possibilités d’échanges d’eau et d’autres éléments. On voit clairement sur des images réalisées au microscope électronique les nombreuses connexions entre les éléments du xylème et les cellules adjacentes, que ce soit des cellules des éléments conducteurs voisins ou d’autres types ou familles cellulaires. La photo 2 en offre une belle illustration. Les cellules échangeuses d’eau avec le xylème sont multiples, cellules-compagnes des éléments conducteurs (Holbrook 1995), ou cellules du xylème ayant cavité puis étant embolisées [3] (Zimmermann 1983, Tyree & Yang 1990) ; de l’eau peut aussi simplement provenir du milieu extracellulaire.
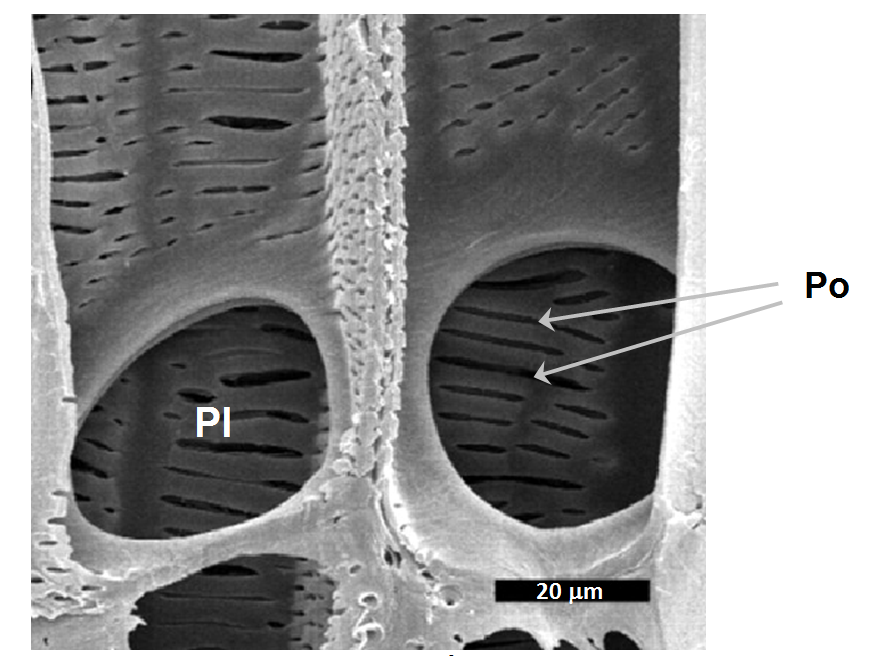
Photo 2. Coupe longitudinale d’une portion de xylème de Parathesis chiapensis (un arbuste poussant au Mexique), montrant deux vaisseaux adjacents. On y voit très bien de grosses plaques perforées (Pl), qui sont les vestiges de la terminaison des cellules primitives et les fines ponctuations latérales (Po), de type réticulé qui permettent la communication entre vaisseaux et parenchyme. La petite barre horizontale, en bas à droite de la photo, indique l’échelle de la photo. Tiré de Jansen et al. (2004).
La communication entre deux éléments conducteurs adjacents du xylème (vaisseaux ou trachéïdes selon les espèces) permet la redondance, synonyme de sécurité en cas de dysfonctionnement d’un de ces éléments. Elle met en jeu la myriade de ponctuations situées entre les éléments conducteurs de la sève brute et les cellules de parenchyme et qui permettent d’accéder à un ensemble de petits réservoirs, les vacuoles. Evidemment, de tels transferts d’eau ne s’effectuent pas librement, un certain nombre de barrières intelligentes les régulent. Une autre illustration de cet arrangement cellulaire est présenté sur la Fig. 13. Sur cette figure, les différentes cellules d’une portion de xylème sont représentées en coupe transversale, montrant le gainage d’un vaisseau de xylème par un grand nombre de cellules de parenchyme.
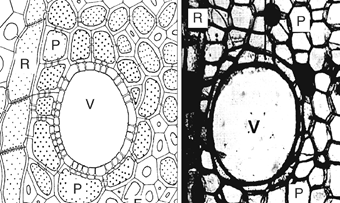
Figure 13. Deux coupes transversales montrant l’anatomie fonctionnelle du système de conduction hydrique et du stockage de l’eau dans la tige de deux espèces d’arbres. A gauche, chez le frêne (Fraxinus excelsior L.) un gros vaisseau (V) est entouré par des cellules de parenchyme (P) ; à droite, coupe réalisée chez une espèce tropicale (Bombax sp.). Tiré de Borchet et Pockman (2005)
4.4. Potentiel de base et évapotranspiration des couverts végétaux
Le fait que le potentiel de base représente le potentiel hydrique du sol dans ses zones à la fois les plus humides et les plus colonisées a incité les chercheurs à rechercher s’il existait une relation entre sa valeur et le « confort hydrique » ressenti par la plante sur lequel il est mesuré. Ce confort « ressenti » a été exprimé par l’évapotranspiration relative (rET), qui est le rapport que l’on écrit ETR/ETM entre l’évapotranspiration réelle [4] et l’évapotranspiration maximale.
La Fig.14, d’après Itier et al. (1992), permet de comparer les relations obtenues par différents auteurs pour des cultures variées. On constate un assez bon accord entre les différentes expériences, avec une évapotranspiration relative qui reste maximale tant que le potentiel n’atteint pas -0,3 MPa (-3 bars). L’evapotranspiration relative décroit ensuite linéairement jusqu’à des valeurs de 0,5 pour des potentiel de base égaux à -1 MPa (-10 bars).
Ce potentiel de base aurait pu être un bon indicateur pour le déclenchement de l’irrigation (en se fixant par exemple un seuil de -0,5 MPa), si la difficulté de sa mesure n’avait été un obstacle : en effet, il faut d’une part effectuer la mesure peu avant le lever du soleil avec une lampe frontale et, de plus, c’est une mesure délicate à faire sur un échantillon d’une dizaine de plantes avec une chambre de Scholander. Cela reste une mesure de spécialistes et non pas une mesure « grand public »
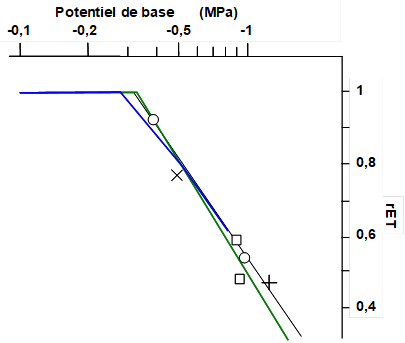
Figure 14. Comparaison des relations entre l’évapotranspiration relative (rET) et le potentiel de base (échelle logarithmique) trouvées sur différentes cultures : ![]() luzerne (Itier et al 1992),
luzerne (Itier et al 1992),
![]() tomate (Itier et al. 1990),
tomate (Itier et al. 1990), ![]() blé (Meyer & Green 1980), (+) coton (Jordan & Ritchie 1971), (O) luzerne (Riou et al 1986), (X) luzerne (Sharrat et al. 1983), (□) blé (Sharrat et al. 1974)
blé (Meyer & Green 1980), (+) coton (Jordan & Ritchie 1971), (O) luzerne (Riou et al 1986), (X) luzerne (Sharrat et al. 1983), (□) blé (Sharrat et al. 1974)
Sommaire :
- I. OUTILS ET CONCEPTS DE BASE
- II. ETATS ET TRANSFERTS HYDRIQUES DANS ET À TRAVERS LA PLANTE
- II.1. La cellule en tant que compartiment hydrique
- Introduction : la cellule végétale vivante
- Le potentiel hydrique de la cellule et ses composantes.
- Relation potentiel hydrique – volume cellulaire : le diagramme de Höfler
- L’osmorégulation
- Les transferts d’eau transmembranaires
- Importance des relations hydriques pour l’expansion cellulaire
- Mesure des composantes du potentiel hydrique cellulaire
- Références bibliographiques
- II.2. Anatomie des voies de transfert de l’eau dans la plante
- II.3. L'eau dans les tissus et les organes de la plante et ses méthodes de caractérisation
- II.4. L’absorption de l'eau du sol par les racines
- II.5. La transpiration foliaire
- II.6. Transferts et états hydriques dans le continuum Sol-Plante-Atmosphère
- II.7. L’architecture hydraulique, la cavitation et l’embolie des plantes
- II.8. Un modèle simple de fonctionnement hydrique à l'échelle de la plante entière. Application pour un arbre
- II.9. Les flux de sève dans la plante : couplage entre xylème et phloème, modélisation
- II.10. L’eau et le métabolisme carboné : C3/C4, CAM ; efficience de l’eau
- II.1. La cellule en tant que compartiment hydrique
- III. FONCTIONNEMENT DES VEGETAUX EN SITUATION DE STRESS LIE A L’EAU
- III.1. Les végétaux face à la sécheresse
- III.2. Efficience agronomique de l’eau
- Les composantes de l’efficience d’utilisation de l’eau par les cultures.
- Nécessité de quantifier séparément Evaporation du sol et Transpiration des plantes
- Les interactions entre nutrition azotée et alimentation hydrique, conséquence sur l’efficience d’utilisation de l’eau par les cultures.
- Références bibliographiques
- IV. AGRONOMIE DE L’EAU





