Mesure des composantes du potentiel hydrique cellulaire
Alors que le potentiel hydrique d’un organe est mesuré avec une chambre de Scholander ou un psychromètre (cf. chapitre II.3), on ne peut mesurer le potentiel hydrique d’une cellule directement. On considérait donc que le potentiel hydrique cellulaire moyen était celui de l’organe mais cela prévenait toute étude de la variabilité de ce paramètre et ses composantes au sein d’un organe. Dans les années 80, des outils particuliers ont été mis au point pour accéder aux composantes du potentiel hydrique à l’échelle de la cellule. Le micromanomètre intracellulaire et le picolitre osmomètre permettent respectivement la mesure de la pression de turgescence et la pression osmotique d’une cellule. Le potentiel hydrique cellulaire est calculé par la différence entre ces deux paramètres (§ II.1.1).
La sonde à pression cellulaire ou micromanomètre intracellulaire a été mise au point en 1978 pour mesurer la pression de turgescence d’une cellule directement et in vivo (Hüsken et al., 1978). Initialement utilisée sur une cellule géante d’algue, elle a été miniaturisée et permet maintenant de sonder les petites cellules des plantes supérieures (Steudle, 1993). Le micromanomètre (Fig. 9) est constitué d'une micro chambre sur laquelle sont branchés :
- un transducteur de pression ;
-un micro capillaire de verre qui réalise le pont entre la micro chambre et l'intérieur de la cellule ;
- un piston commandé par un petit moteur électrique qui permet d'augmenter ou de réduire le volume de la micro chambre et donc d'y faire varier la pression. On notera que l'huile de silicone qui remplit la micro chambre est incompressible tout comme le suc cellulaire. Par contre, le Plexiglas (qui constitue la micro chambre) et les différents joints sont des matériaux très légèrement élastiques ;
- une vanne d'ouverture rapide de la micro chambre, constituée d'un bras actionné par un solénoïde et appuyant sur l'extrémité d'une aiguille. Ce dispositif permet une chute instantanée de la pression dans la chambre et permet de collecter le suc cellulaire sans le diluer.
La partie mécanique du micromanomètre intracellulaire est fixée sur un micromanipulateur qui permet des micromouvements et donc l'empalement d'une seule cellule à la fois (voir Fig. 10). La plantule sur laquelle on veut faire des mesures est fixée dans une plate-forme, elle-même fixée à un second micromanipulateur. Microcapillaire et organe à sonder sont positionnés avec précision sous l'objectif de la loupe binoculaire grâce à ces manipulateurs. Une lampe à lumière froide dispense l'éclairage par deux bras semi-souples. Micromanomètre, plateforme et loupe binoculaire sont posés sur une table "anti-vibration" afin d'absorber les vibrations externes.
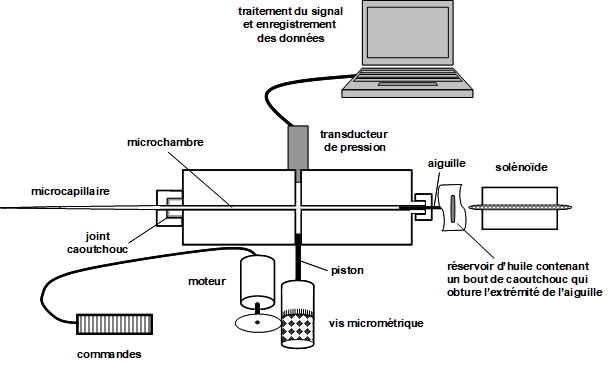
Figure 9. Schéma du micromanomètre intracellulaire.

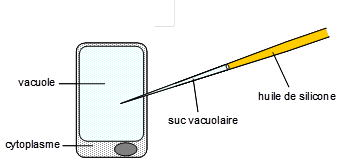
Figure 10. Photo du micromanomètre intracellulaire montrant sous la loupe binoculaire la platine portant l’échantillon végétal et l’aiguille de verre guidée par un micromanipulateur. La figure du bas montre de façon schématique la position idéale de l’aiguille qui empale la vacuole d’une cellule.
Le micromanomètre intracellulaire possède des avantages importants. Il permet des mesures directes de la pression de turgescence, in vivo. Les dérives de mesure rencontrées classiquement avec les mesures indirectes sont supprimées. En effet, la détermination de la turgescence par différence entre le potentiel hydrique et le potentiel osmotique (mesurés par psychrométrie) sur des tissus peut conduire à des valeurs erronées, le potentiel hydrique de l'apoplasme et les phénomènes de relaxation des parois cellulaires n'étant pas pris en compte.
Le micromanomètre intracellulaire permet une résolution spatiale très fine et permet ainsi d'étudier la croissance de façon très précise. Les avantages de cette méthode sont cependant à pondérer par quelques inconvénients. D'une part, les mesures sont longues et difficiles. L'étanchéité entre le capillaire et la cellule est très fragile et la moindre vibration conduit à une fuite et à l'échec de la mesure. D'autre part la taille de la cellule reste limitante. Les mesures sont très difficiles si le diamètre cellulaire est inférieur à 10 µm. De plus, si la cellule n'est pas très vacuolisée comme c'est le cas des très jeunes cellules en croissance, le risque que l'extrémité du capillaire se bouche (obstruction par un composé du cytoplasme) augmente très fortement.
En sus de la mesure de la pression de turgescence, les variations temporelles de P en réponses à des perturbations de l’équilibre hydrique de la cellule avec son milieu (changement de pression osmotique du milieu, variation de P via la sonde) permet de mesurer le module d’élasticité cellulaire e et la conductivité hydraulique membranaire Lp (sous réserve d’avoir une idée du ratio surface/volume de la cellule) (cf. § II.1.4).
Le picolitre osmomètre
Cet osmomètre a été mis au point pour mesurer la pression osmotique d'échantillons de très faible volume, jusqu'à une dizaine de picolitres (10-12 l) (Malone et Tomos, 1992). Il permet la mesure de la pression osmotique du contenu d'une seule cellule. La pression osmotique est déterminée par mesure du point de fusion du dernier cristal. Cette méthode consiste à congeler l'échantillon puis, lors d'un réchauffement lent à mesurer avec précision la température de fusion du dernier cristal. Cette température est proportionnelle à l'osmolalité de l'échantillon (loi de Van't Hoff). Il suffit d'étalonner l'osmomètre avec des solutions de NaCI d'osmolalité connue.
Le picolitre osmomètre est constitué de plusieurs éléments:
- L'appareil de mesure, constitué d'une petite chambre où se trouve une petite plateforme de cuivre (1,5 cm x 1,5 cm) qui reçoit les échantillons (Fig. 11). Cette chambre est couverte par une lamelle de microscope coulissant au dessus de la fenêtre.
- Un groupe électrique qui permet de refroidir la plateforme de cuivre, par effet Peltier, jusqu'à -40 °C en une minute.
- Un système de tubes amenant un flux d'air sec au dessus et dans la chambre de mesure.
- Un boîtier de contrôle de la température (avec une précision de 0,02 °C) et de déclenchement des cycles de congélation.


Figure 11. Le picolitre osmomètre. En haut : photo du dispositif expérimental. En bas, schéma de principe montrant la goutte extraite de la vacuole puis déposée sur la lamelle de verre, dont les solutés sont cristallisés par l’effet de l’abaissement de la température de la platine en cuivre.
La miniaturisation de l'osmomètre permet de mesurer la pression osmotique du contenu d'une seule cellule. Le picolitre osmomètre se distingue des autres méthodes (psychrométrie, hygrométrie) qui procèdent sur des échantillons tissulaires et donc sur un mélange de suc cellulaire et d'apoplasme. De plus, comme pour le micromanomètre intracellulaire, la résolution spatiale très fine est un atout pour l'étude de la croissance. La précision de la mesure est bonne (± 0.02 MPa). La taille des cellules n'est en général pas limitante. De plus, il est toujours possible d'empaler 2 ou 3 cellules contiguës pour augmenter la taille de l'échantillon.
Sommaire :
- I. OUTILS ET CONCEPTS DE BASE
- II. ETATS ET TRANSFERTS HYDRIQUES DANS ET À TRAVERS LA PLANTE
- II.1. La cellule en tant que compartiment hydrique
- Introduction : la cellule végétale vivante
- Le potentiel hydrique de la cellule et ses composantes.
- Relation potentiel hydrique – volume cellulaire : le diagramme de Höfler
- L’osmorégulation
- Les transferts d’eau transmembranaires
- Importance des relations hydriques pour l’expansion cellulaire
- Mesure des composantes du potentiel hydrique cellulaire
- Références bibliographiques
- II.2. Anatomie des voies de transfert de l’eau dans la plante
- II.3. L'eau dans les tissus et les organes de la plante et ses méthodes de caractérisation
- II.4. L’absorption de l'eau du sol par les racines
- II.5. La transpiration foliaire
- II.6. Transferts et états hydriques dans le continuum Sol-Plante-Atmosphère
- II.7. L’architecture hydraulique, la cavitation et l’embolie des plantes
- II.8. Un modèle simple de fonctionnement hydrique à l'échelle de la plante entière. Application pour un arbre
- II.9. Les flux de sève dans la plante : couplage entre xylème et phloème, modélisation
- II.10. L’eau et le métabolisme carboné : C3/C4, CAM ; efficience de l’eau
- II.1. La cellule en tant que compartiment hydrique
- III. FONCTIONNEMENT DES VEGETAUX EN SITUATION DE STRESS LIE A L’EAU
- III.1. Les végétaux face à la sécheresse
- III.2. Efficience agronomique de l’eau
- Les composantes de l’efficience d’utilisation de l’eau par les cultures.
- Nécessité de quantifier séparément Evaporation du sol et Transpiration des plantes
- Les interactions entre nutrition azotée et alimentation hydrique, conséquence sur l’efficience d’utilisation de l’eau par les cultures.
- Références bibliographiques
- IV. AGRONOMIE DE L’EAU
Dans le chapitre :
- Introduction : la cellule végétale vivan...
- Le potentiel hydrique de la cellule et s...
- Relation potentiel hydrique – volume cel...
- L’osmorégulation
- Les transferts d’eau transmembranaires
- Importance des relations hydriques pour ...
- Mesure des composantes du potentiel hydr...
- Références bibliographiques





