L’architecture hydraulique, la cavitation et l'embolie des plantes


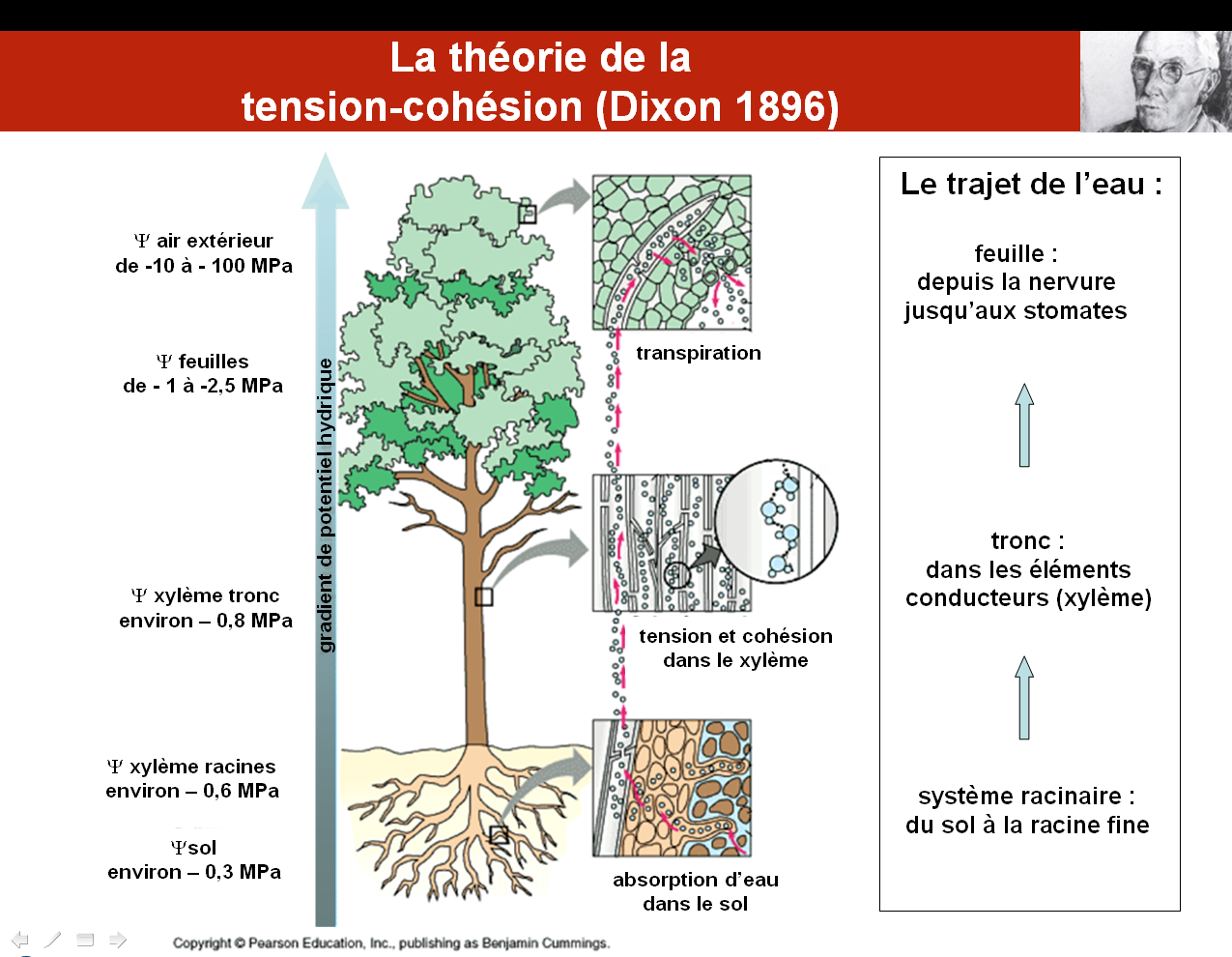
La théorie de la tension-cohésion a été formalisée depuis plus d’un siècle par un grand botaniste irlandais, H.H. Dixon. Celui-ci a explicité les bases physiques de la montée de la sève brute dans les végétaux, sous l’action de la transpiration foliaire. On se reportera aux chapitres II.5 et II.6 qui présentent en détail ces mécanismes.
Ce qu’il faut retenir, c’est le rôle moteur et direct du potentiel hydrique1, qui explique le mouvement de la sève à partir des feuilles, la faisant monter de proche en proche par les pétioles, les rameaux, les tiges et les racines. Cette eau est prélevée dans le sol grâce à ce mouvement d’aspiration.
On voit sur ce schéma, qui reporte des valeurs classiquement mesurées du potentiel hydrique, que certaines parties de la plante (ici un arbre) sont soumises à de très faibles potentiels hydriques (= de fortes succions). C’est en particulier le cas des feuilles dont l’eau des nervures est typiquement portée à un potentiel hydrique de l’ordre de – 1 MPa, souvent plus faible, jusqu’à – 2.5 MPa, voire encore plus faible. Soumises à ces fortes tensions hydrauliques, les feuilles et les petits rameaux qui les portent sont les éléments les plus vulnérables de la plante.
1 le potentiel hydrique est le plus souvent négatif dans toute la plante, l’eau étant sous tension et non sous pression
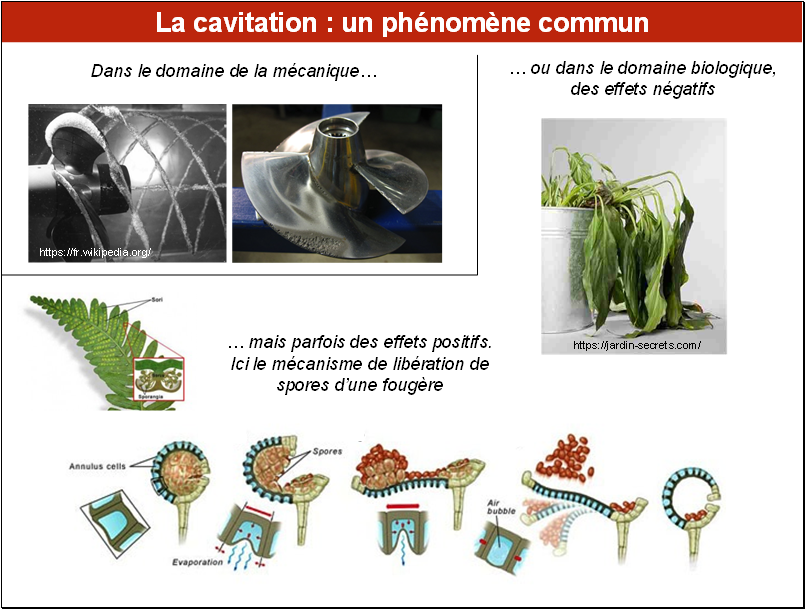
La cavitation correspond à la formation de petites bulles de vapeur, sans élévation de température dans l'eau, le plus souvent par une action mécanique.
C’est un phénomène que l’on observe dans des domaines très différents. La cavitation est bien connue en hydraulique et en mécanique, par exemple sur des hélices de bateaux qui tournent trop vite. La photo en haut à gauche montre la formation de petites bulles, qui sont générées à l’extrémité des pales de ce bateau, là où la vitesse est la plus élevée. On voit sur la photo adjacente les conséquences après un fonctionnement prolongé dans ces conditions : le métal de l’hélice est rongé dans les zones où la cavitation se produit.
Chez les végétaux, si la cavitation, qui est le plus souvent provoquée par la sécheresse, peut avoir des conséquences négatives conduisant à des chutes anormales de feuilles ou de rameaux, voire à leur mort, la cavitation est parfois un mécanisme astucieux, utilisé par les plantes, par exemple ici pour la dispersion des spores d’une fougère.
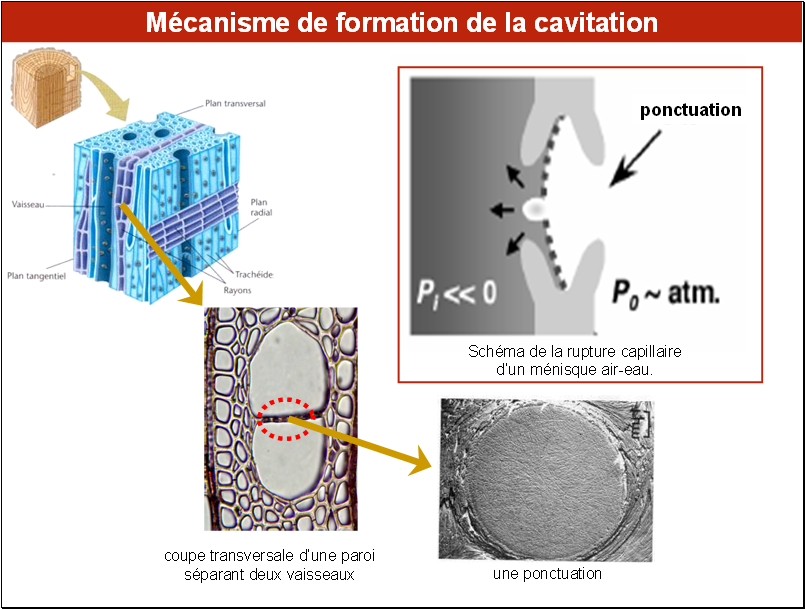
Le schéma de gauche montre une portion du xylème de bois d’un arbre (ici une espèce feuillue) selon ses 3 dimensions : transversale, radiale et tangentielle sous différents grossissements. On y distingue des vaisseaux, trachéïdes et d’autres éléments constituant le xylème. On voit, sur le plan tangentiel, que les vaisseaux sont, ce qui est un cas fréquent, contigus. Entre deux éléments accolés, il existe des communications, appelées les ponctuations (voir photo). Ce sont des zones permettant à la sève de suivre plusieurs chemins, ce qui correspond à une stratégie de redondance, très utile en cas d’accident hydraulique.
La figure encadrée à droite schématise l’entrée d’une bulle d’air depuis une cellule de xylème ayant cavité vers une autre remplie de sève : une petite bulle se forme par aspiration lorsque le potentiel hydrique Pi devient inférieur à un certain seuil. Si l’on revient à l’arrangement des deux vaisseaux accolés dont nous avons parlé, on voit que les ponctuations représentent des zones de vulnérabilité, car si une bulle se forme dans un des vaisseaux, celle-ci pourra se propager dans le ou les vaisseaux voisins.
Noter que d’autres contraintes que la sécheresse peuvent induire la cavitation chez les végétaux, citons le gel ou des attaques mécaniques des tissus conducteurs de la sève brute par des insectes.
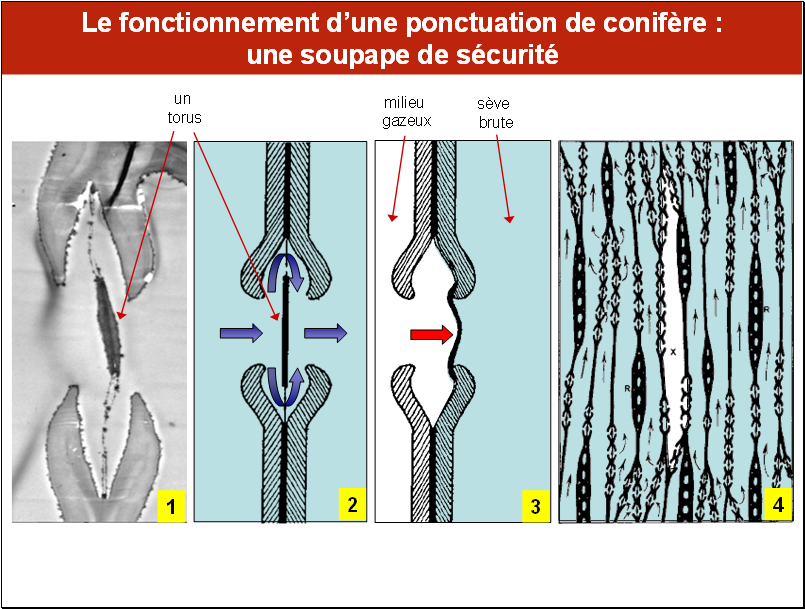
Toutefois, un certain nombre d’adaptations anatomiques permettent de protéger le xylème contre la propagation d’air depuis un élément conducteur de la sève à un autre. Un cas bien connu est celui des ponctuations aréolées, qui possèdent un épaississement appelé torus (Fig. 1), qui est porté par un réseau poreux de fibrilles. En conditions normales, l’eau peut passer d’un élément à son voisin au travers de la ponctuation (Fig. 2). Mais le torus peut agir comme une soupape de sécurité. Lorsque de l’air envahit une trachéide et se trouve porté à une pression proche de la pression atmosphérique, la différence de pression avec la trachéide adjacente (dont le potentiel hydrique est négatif) va plaquer le torus contre la lumière de la ponctuation (Fig. 3). En conséquence, l’air reste emprisonné dans la seule trachéide embolisée et il y n’y aura pas propagation de l’embolie (Fig. 4).



La mesure de la cavitation (la rupture des colonnes d’eau dans les vaisseaux et trachéides du xylème) ou de l’embolie (le remplissage de l’élément de xylème par de l’air juste après la cavitation) est couramment pratiquée sur les plantes par les chercheurs et mise en relation avec les facteurs de l’environnement, notamment les stress. Cette mesure peut être réalisée au moyen de méthodes basées sur différents principes que nous verrons plus loin.
Pour provoquer la cavitation, la méthode de centrifugation consiste à imposer par paliers des vitesses de rotation croissantes à un tissu ou un organe, souvent un segment de rameau ou de branche. On utilise une centrifugeuse de laboratoire de grande dimension. La rotation induit une force centrifuge, qui se traduit par une traction de l’eau contenue dans les éléments du xylème aux deux extrémités de l’échantillon végétal, force d’autant plus grande que la vitesse de rotation est élevée. A chaque palier de vitesse, on effectue une mesure du taux de cavitation par une des méthodes que nous détaillons plus loin.
La méthode par déshydratation est la plus simple à mettre en œuvre : des plantes entières en pot ou des rameaux feuillés sont placés en condition de dessèchement, souvent au laboratoire dans des conditions contrôlées de température et humidité de l’air.
Enfin, la méthode par injection d’air consiste à appliquer à l’échantillon végétal une surpression d’air dans une chambre munie d’un manomètre.
Lorsqu’on a appliqué une contrainte hydrique d’un certaine intensité (par dessèchement, centrifugation ou injection d’air), on réalise la mesure de la cavitation qui en résulte. En réalité, on va mesurer le degré d’embolie consécutive à la cavitation, les tissus conducteurs se retrouvant alors partiellement ou totalement remplis d’un mélange gazeux (air et vapeur d’eau). Cette embolie entraîne la limitation, voire le blocage total, de la circulation de l’eau dans les tissus conducteurs (voir au Chapitre II.6 les conséquences sur le fonctionnement de la plante entière).
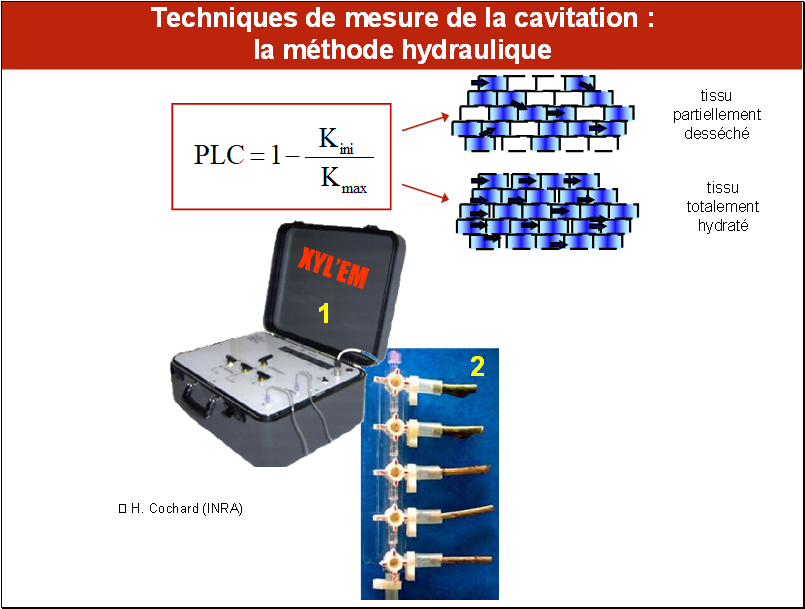
La méthode de référence est la méthode hydraulique, qui consiste à mesurer la conductance hydraulique initiale Kini (la conductance hydraulique représente la facilité avec laquelle l’eau peut circuler dans le xylème d’un organe) pour un niveau de contrainte donné, puis la conductance hydraulique maximale Kmax, lorsque l’organe est pleinement hydraté. Un appareillage spécifique (XYL’EM, photo 1) a été développé par l’INRA pour réaliser de telles mesures.
Pour mesurer Kini, l’opérateur, qui manipule dans un bac rempli d’eau pure, coupe des fragments du végétal (sur la photo 2, ce sont 5 petits segments de branches), les raccorde à des tuyaux souples remplis d’eau pure et munis de robinets. Une extrémité de cette rampe est raccordée à un réservoir d’eau dont on peut régler précisément la pression. Un débitmètre contenu dans l’appareil permet de mesurer le débit de l’eau dans l’échantillon sélectionné par l’ouverture du robinet correspondant. Lorsque le débit est stable, on peut calculer la conductivité hydraulique Kini : c’est le rapport entre le débit d’eau et la pression appliquée. Cette mesure est répétée autant de fois qu’il y a d’échantillons sur la rampe. Ensuite, les échantillons sont saturés par perfusion d’eau dégazée sous pression. La conductivité hydraulique des échantillons est alors à nouveaux mesurée : on obtient Kmax.
On définit la perte de conductivité hydraulique PLC consécutive à l'enbolie comme étant égale à 100 x (1 - Kini/Kmax). Nous utiliserons largement ce terme par la suite.

D’autres méthodes sont utilisées par les chercheurs :
• La méthode dite acoustique mesure le nombre d’émissions acoustiques (des « clics » ultrasoniques) lors de la rupture des colonnes d’eau dans les éléments conducteurs de la sève brute. Un exemple de ces mesures est présenté ici, montrant, au cours d’une journée ensoleillée, un taux d’émissions acoustiques beaucoup plus important pour un pied de maïs soumis à une sécheresse que chez le témoin bien irrigué. Le maximum de taux de cavitation est observé en milieu de journée, aux heures les plus chaudes.
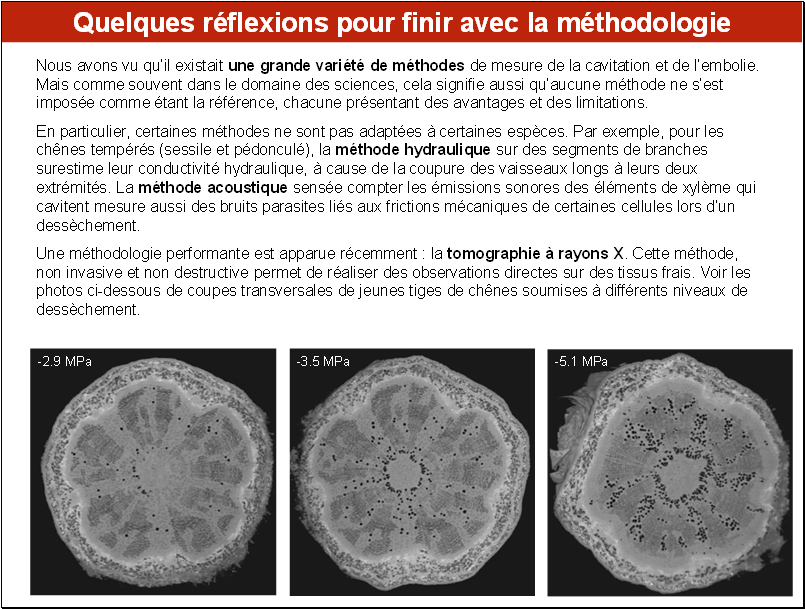
• Le développement des techniques d’observation d’échantillons à leur état naturel permet maintenant de visualiser (et de compter) les zones où l’eau est présente ou non dans les éléments du xylème d’une plante. Ce sont les méthodes dites cytologiques, mettant en œuvre des appareils de tomographie à rayons X ou des microscopes environnementaux.

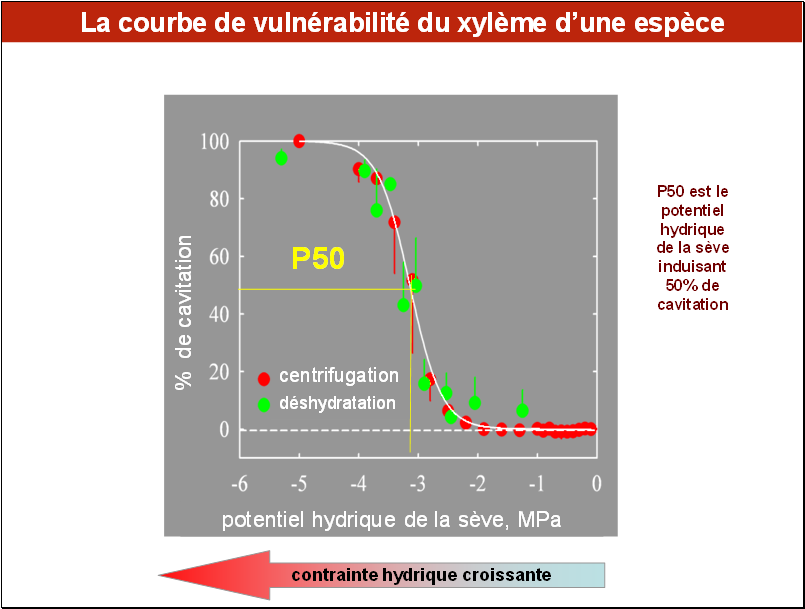
La courbe de vulnérabilité à la cavitation (CV) d’un organe (tige, racine, branche, pétiole….) d’une espèce renseigne quantitativement sur la capacité de son système conducteur de la sève brute à résister à une contrainte hydrique croissante (= la diminution de son potentiel hydrique).
Etablir une courbe de vulnérabilité est simple dans son principe : on soumet et on maintient l’organe (voire la plante entière) à un certain niveau de contrainte hydrique puis on mesure le taux d’embolie de son xylème par la méthode hydraulique. On augmente ensuite l’intensité de la contrainte et on effectue une nouvelle mesure. On procède ainsi de suite par paliers. La courbe de vulnérabilité à la cavitation est obtenue en reportant sur un graphique le taux de cavitation, exprimé en % (appelé aussi PLC) en fonction du potentiel hydrique dans l’organe mesuré.
L’exemple présenté ici, obtenu chez le pin sylvestre, montre deux choses :
• Lorsque la contrainte hydrique est faible ou nulle (lire le graphique de droite à gauche), le % de cavitation est proche de zéro (pour certaines espèces, il est faible mais non nul). Lorsque la contrainte hydrique augmente, ici vers – 2,5 MPa, PLC augmente d’abord faiblement puis très rapidement. Enfin, à des niveaux de contrainte très forte, ici < - 4 MPa, le % de cavitation devient proche de 100%, signifiant que tous les vaisseaux ou trachéides sont embolisés. Un paramètre important est la valeur du potentiel hydrique qui induit 50% de cavitation. Il est appelé P50 et permet des réaliser des comparaisons quantitatives entre les espèces.
• Nous avons représenté ici des résultats obtenus par deux méthodes : la centrifugation et la déshydratation. On voit l’excellente concordance entre elles. Sur cette espèce l’une ou l’autre méthode peut être utilisée indifféremment.
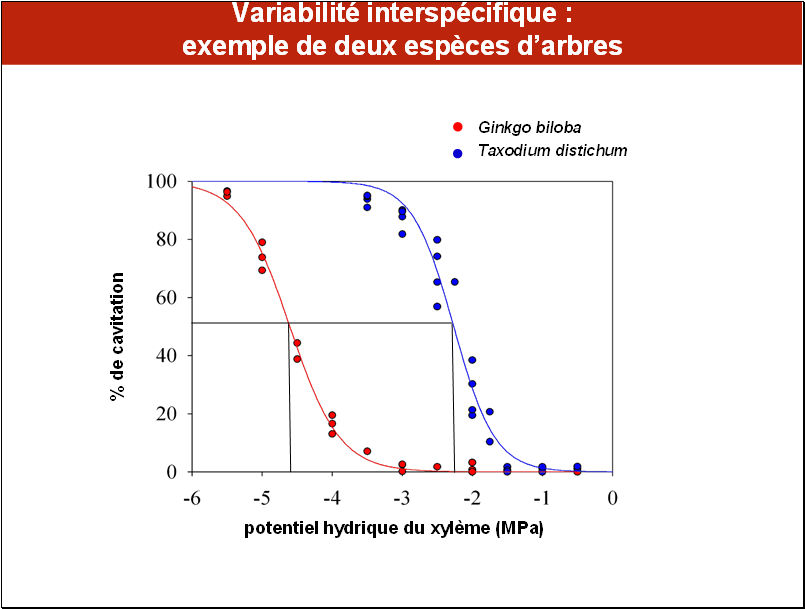
Les mesures montrent qu’il existe une très forte variabilité de vulnérabilité à la cavitation entre espèces.
Nous avons représenté ici la réponse de deux espèces d’arbres, le ginkgo ou « arbre aux quarante écus » (Ginkgo biloba), que l’on trouve en Chine et au Japon et le cyprès chauve d’Amérique (Taxodium distichum), originaire des milieux humides de Louisiane aux USA, pour illustrer les écarts que l’on peut trouver entre les espèces.
Si les courbes de vulnérabilité des deux espèces ont presque exactement la même forme, elles sont décalées d’environ 2 MPa, ce qui est considérable en terme de contrainte hydrique. La cavitation du cyprès chauve commence à augmenter (lire le graphique de la droite vers la gauche) entre -1,5 et -2 MPa, contre -3,5 et - 4 MPa chez le ginkgo, dénotant chez cette dernière espèce une beaucoup plus faible vulnérabilité à la cavitation. Les valeurs de P50 sont respectivement de –2,3 et -4,7 MPa pour le cyprès chauve et le ginkgo.
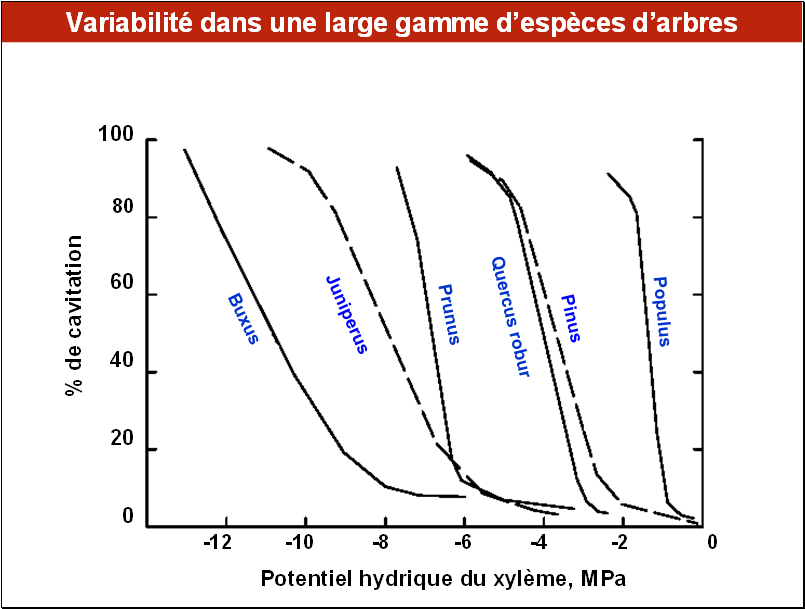
Chez les arbres, en considérant un plus large éventail d’espèces, on trouve tous les comportements intermédiaires entre des espèces très sensibles et d’autres très résistantes, comme on peut le constater sur cette figure.
Le peuplier (Populus deltoïdes) représenté ici est l’espèce la plus vulnérable, alors que le buis (Buxus) est la plus résistante. Entre ces deux extrêmes, on trouve un pin (Pinus sylvestris), le chêne pédonculé (Quercus robur), un cerisier sauvage (Prunus cerasifera) et le genévrier (Juniperus). Assez globalement, on constate que les espèces les plus résistantes à la cavitation sont adaptées pour pousser dans les milieux secs.
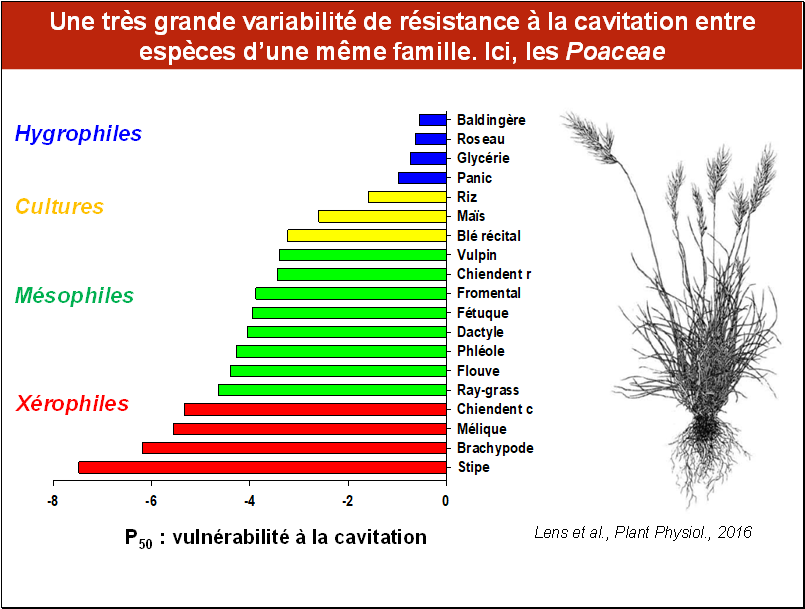
Dans le cas des plantes herbacées, ici au sein d’une même famille botanique, les poacées1 appelées aussi graminées, nous avons représenté les valeurs de P50 de quelques espèces. Elles ont été séparées selon leur habitat : celles poussant dans des milieux humides (hygrophiles), celles des milieux intermédiaires (mésophiles) et celles des milieux arides (xérophiles). Les espèces cultivées ont aussi été distinguées.
On voit clairement que le paramètre P50 est moins bas (de l’ordre de – 1 MPa) chez les espèces hygrophiles, indiquant une forte vulnérabilité à la cavitation. Le P50 est plus faible (entre - 3 et – 4 MPa) pour les espèces mésophiles et il est très faible chez les xérophiles (entre - 5 et – 7 MPa), ces dernières étant caractérisées par une très faible vulnérabilité à la cavitation, indiquant leur très bonne adaptation aux conditions arides. On constate aussi que les cultures annuelles sont relativement vulnérables à la cavitation, mais on sait que le riz pousse en conditions très humides, que le maïs est le plus souvent irrigué en condition de climat sec. Le blé n’est pas irrigué, mais sa période de croissance intervient au printemps lorsque le sol est encore humide.
1 les poacées forment une très grande famille botanique qui compte environ 12000 espèces
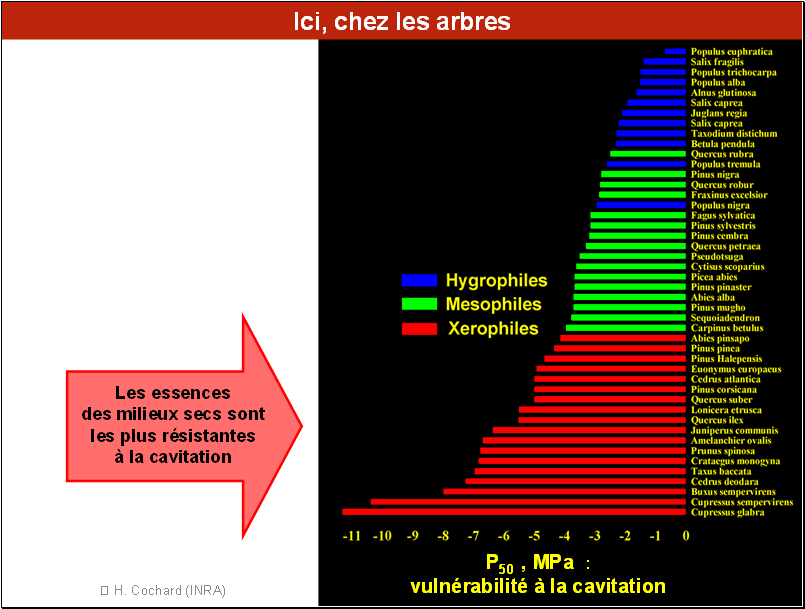
Chez les arbres, pour un nombre d’espèces encore plus grand, on retrouve ce même classement entre espèces de milieux humides, intermédiaires et arides, avec une très large gamme de variation du paramètre P50. Celui-ci varie entre -1 MPa pour un peuplier et – 11 MPa pour une espèce de cyprès.

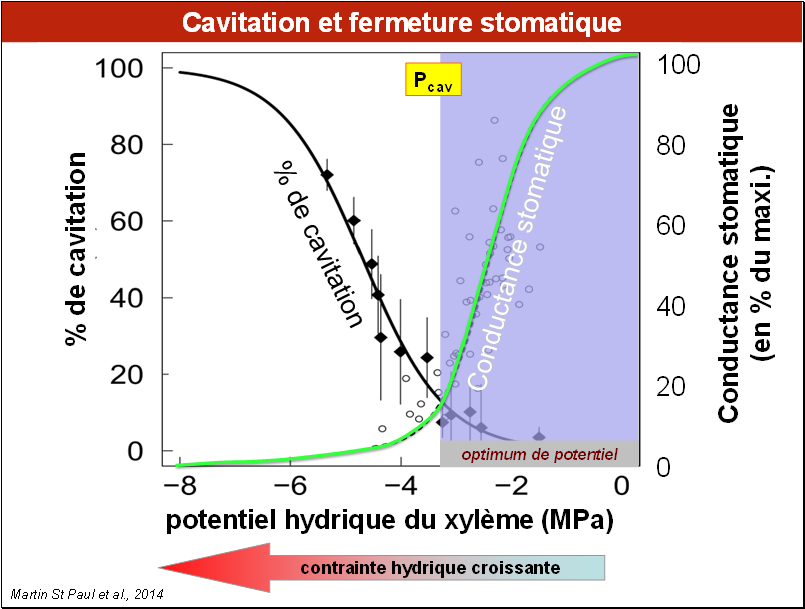
Il existe chez de nombreuses espèces végétales un mécanisme de protection, limitant, voire évitant une diminution trop importante de leur potentiel hydrique : la fermeture des stomates. Ce mécanisme et ses conséquences sont détaillés dans les Chapitres II.5 et II.6.
Lorsque le dessèchement du sol progresse (lire le graphique de la droite vers la gauche), des mécanismes biophysiques, mettant en jeu le potentiel hydrique foliaire et des signaux biochimiques produits par la plante, provoquent la fermeture partielle ou totale des stomates. C’est ce qu’on voit sur la courbe en vert, dans le cas d'un chêne vert (Quercus ilex), qui passe de 100% d’ouverture stomatique à 20% lorsque le potentiel hydrique descend de 0 à -3 MPa. La transpiration diminue proportionnellement, limitant la chute du potentiel hydrique. La cavitation ne commence à augmenter significativement que lorsque le potentiel hydrique descend au-dessous d’un certain niveau. On constate sur cette figure un très bon synchronisme entre les deux phénomènes.
On a représenté sur cette figure une valeur importante pour la plante, appelée ici Pcav. C’est le seuil de potentiel hydrique à partir duquel la cavitation se développe rapidement, seuil que la plante ne doit pas dépasser sous peine de dommages importants à son système conducteur. Pour le chêne vert représenté ici, Pcav = - 3,5 MPa.
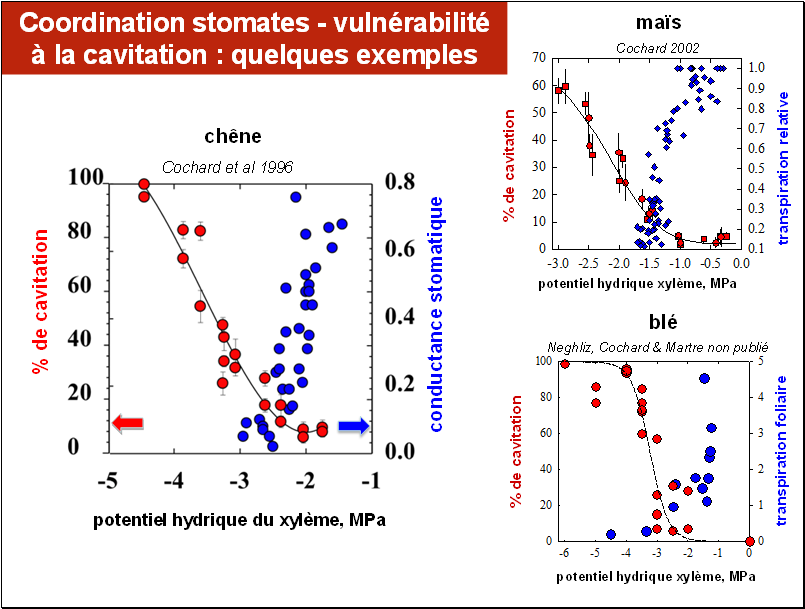
Comme dans la figure précédente nous avons représenté, ici pour trois espèces, le chêne, le maïs et le blé, la coordination entre la conductance stomatique (points de couleur bleue, échelle de droite) et le développement de la cavitation (points de couleur rouge, échelle de gauche). La fermeture stomatique est appréhendée ici de plusieurs manières : pour le chêne, par la mesure directe de la conductance stomatique, pour le maïs, par sa transpiration relative (exprimée par rapport à la transpiration maximale) et pour le blé, par sa transpiration foliaire proprement dite. Les unités sont évidemment différentes, mais cela n’a pas d’importance ici. L’échelle va de 0 (stomates fermés, donc pas de transpiration) jusqu’au maximum mesuré pour chaque espèce, lorsque la plante est alimentée en eau de façon optimale.
On constate que globalement, lorsque la sécheresse s’accentue (toujours lire les graphiques de la droite vers la gauche), le taux de cavitation augmente rapidement à partir d’un seuil de potentiel hydrique différent selon les espèces : -1,5 MPa pour le maïs et -2,5 MPa pour le blé et pour le chêne. On voit surtout que lorsque le taux de cavitation dépasse 15 à 20% la conductance stomatique et la transpiration sont fortement réduites. Il y a donc un ajustement par la plante qui permet de la protéger et que l’on appelle la coordination entre les fonctionnements stomatique et hydraulique. Les mesures montrent que cette coordination semble être partagée par des espèces aussi différentes que les arbres et les plantes herbacées.
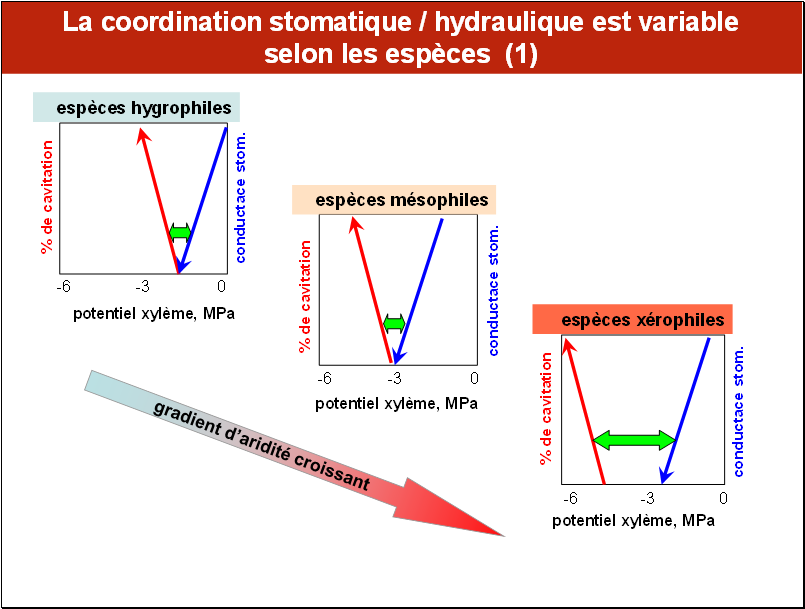
Toutefois, des mesures réalisés sur un plus grand nombre d’espèces, montrent que les caractéristiques de cet ajustement est sujet à des variations, qui paraissent liées à l’adaptation des espèces à leur milieu.
Pour simplifier la lecture, nous avons représenté ici sur chaque figure les variations conjointes de la conductance stomatique et de celle du % de cavitation en fonction du potentiel hydrique par deux segments de droite : bleu pour la conductance stomatique et rouge pour la cavitation. Il apparaît que chez les espèces hygrophiles (celles qui poussent dans des milieux humides) et chez les mésophiles (celles de milieux intermédiaires), la coordination est très étroite : les seuils de potentiel hydrique déclenchant respectivement 90% de fermeture stomatique et 10% de cavitation sont très proches.
En revanche, ce n’est plus le cas chez les espèces xérophiles, celles des milieux arides, chez qui il semble y avoir une «surprotection », les stomates se trouvant fermés bien avant que la cavitation ne puisse se déclencher. L’écart entre ces deux seuils de potentiel hydrique est appelé marge de sécurité.
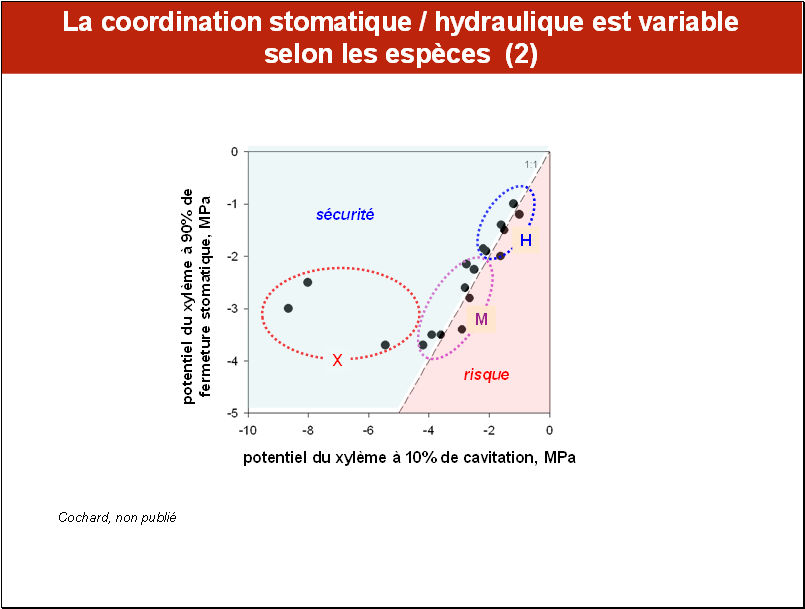
En reprenant les mêmes espèces que celles ayant servi pour la diapo précédente, nous avons construit cette figure qui montre la relation entre le potentiel hydrique du xylème lorsque la fermeture stomatique atteint 90% en condition de dessèchement, et celui où la cavitation dépasse 10%. S’il y a synchronisme parfait, le point expérimental (un point correspond à une espèce) est situé sur la bissectrice 1:1, figurée ici par un segment de droite tiretée.
On constate que les espèces des milieux hygrophiles (H) et mésophiles (M) suivent étroitement cette relation, indiquant une protection suffisante de leur système conducteur par le mécanisme de fermeture stomatique. En revanche, le groupe des espèces xérophiles (X) des milieux arides, se distingue des deux autres : chez les espèces xérophiles, lorsque la sécheresse progresse, la fermeture stomatique à 90% se déclenche bien avant d’atteindre le niveau de potentiel hydrique qui induit l’augmentation de la cavitation. Les points expérimentaux se trouvent placés dans la zone appelé ici domaine de sécurité (zone de couleur bleu clair) tandis que les deux autres groupes sont situés à la limite entre les domaines de sécurité et celui de risque (zone de couleur rose).

Une vaste étude, portant sur près de 500 espèces d’arbres, angiospermes et gymnospermes, a permis d’analyser si leur marge de sécurité suivait une règle, notamment si elle différait entre les grands types de milieux, des plus secs aux plus humides. Dans cette étude, la marge de sécurité est définie comme la différence entre : 1) le potentiel hydrique minimum journalier1 mesuré in situ et 2) le potentiel hydrique qui induit la mort, i.e. 50% pour les gymnospermes et 88% pour les angiospermes (voir plus loin).
La figure montre les valeurs moyennes (les traits en bleu foncé), ainsi que la variabilité autour de la moyenne (les boîtes rectangulaires et les points les plus extrêmes) pour 4 grands groupes d’espèces, distingués selon la quantité annuelle de précipitations. Il est étonnant de voir ici que la marge de sécurité est similaire entre les différents groupes. On constate aussi qu’il n’y a pas de différences significatives entre les angiospermes et les gymnospermes, ces derniers étant toutefois peu représentés dans les régions tropicales et subtropicales. On notera toutefois une plus forte variabilité autour des valeurs moyennes en zone méditerranéenne.
Cette étude montre qu’il existe une convergence globale de la vulnérabilité des forêts face à la sécheresse, les grands biomes forestiers apparaissant pareillement vulnérables aux accidents hydrauliques. Ceci explique pourquoi les dépérissements forestiers dus aux sécheresses peuvent se produire aussi bien dans les régions arides que dans les régions humides.
1 concernant la mesure du potentiel hydrique ainsi que la définition du potentiel hydrique minimum, se reporter au Chapitre II.6
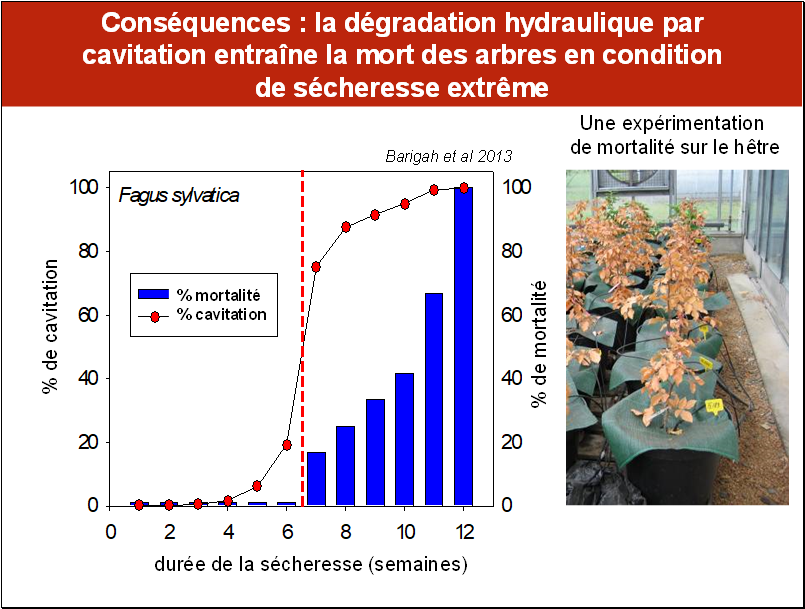
Nous avons vu que la cavitation était un dysfonctionnement très répandu dans le monde des plantes supérieures. Une question intéressant les écophysiologistes et les écologistes est de savoir quelles sont les conséquences, pour une plante, de la cavitation de son système conducteur.
Une expérimentation, conduite sur des jeunes plants de hêtres, a consisté à les soumettre à une sécheresse progressive en supprimant leur arrosage (noter la présence d’une couverture en matière plastique à la surface des pots d’élevage). La mesure du % de cavitation a été réalisée chaque semaine : ce sont les points rouges sur la figure. Tout au long de l’expérience, on a noté la mortalité au même pas de temps, celle-ci étant appréhendée par le brunissement des feuilles (les barres bleues). On peut voir que le % de cavitation est quasiment nul pendant les 4 premières semaines. Il augmente ensuite brutalement aux semaines 6 et 7. Les semaines suivantes, on arrive progressivement à un niveau de cavitation presque total. Si l’on considère la courbe de mortalité, on constate que celle-ci augmente très progressivement à partir de la semaine 7 pour atteindre 100% en fin d’expérience.
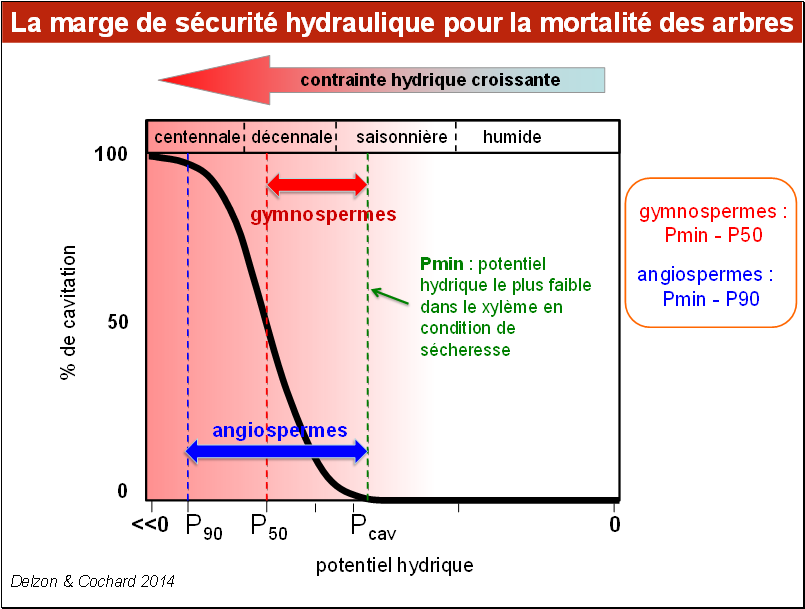
Des études menées sur une quinzaine d’espèces d’arbres semblent montrer qu’il existe une différence importante entre les angiospermes (les feuillus) et les gymnospermes (les conifères) : chez les angiospermes, la mortalité ne devient importante qu’au-delà de 90% de cavitation, contre 50% chez les gymnospermes. La zone de sécurité de ces deux groupes est donc différente : pour les angiospermes, elle est comprise entre Pcav (le potentiel hydrique au-delà duquel la cavitation commence) et P90. Pour les gymnospermes cette marge est plus réduite, comprise entre Pcav et P50.
Ce n’est pas pour autant que l’on puisse en conclure que les gymnospermes sont plus sensibles à la sécheresse, dans la mesure où le dépassement du seuil Pcav dépend beaucoup de l’efficacité de la protection contre la cavitation par fermeture stomatique.
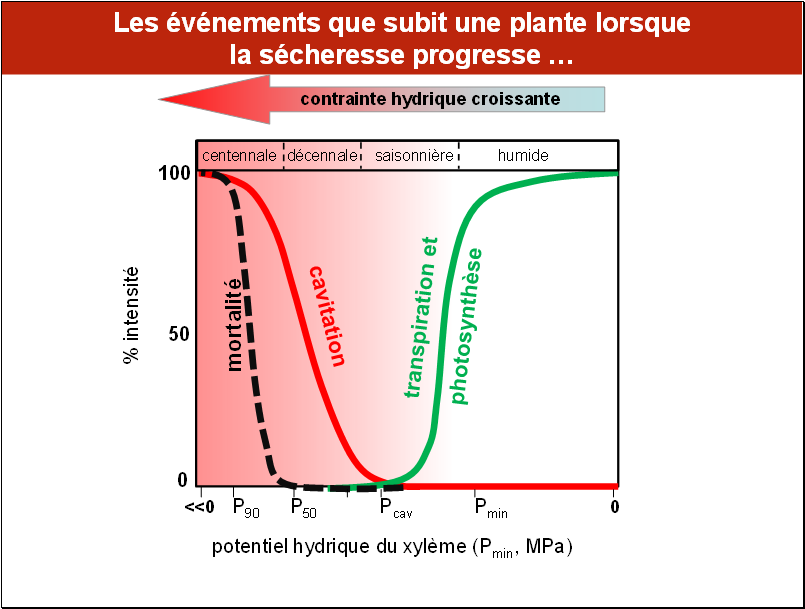
Cette figure résume les principaux évènements que subit une plante « moyenne » lorsque la sécheresse progresse en intensité.
On a tracé en haut du graphique les limites approximatives des différents niveaux de sécheresse : les conditions humides, avec un potentiel hydrique descendant au plus chaud de la journée à une valeur notée Pmin. Puis, des niveaux de sécheresse saisonnière qualifiés de normale, le potentiel hydrique descendant au voisinage du seuil d’induction de la cavitation. Plus loin, des sécheresses très fortes, qualifiées de décennales, avec un potentiel hydrique descendant aux alentours de la valeur P50. Enfin, les sécheresses extrêmes, appelées centennales, où la cavitation peut dépasser 90% (P90). En vert est représentée la diminution des fonctions physiologiques primaires, transpiration et photosynthèse ; en rouge la courbe de l’augmentation du taux de cavitation du xylème, qui est décalée de la précédente ; enfin en noir, on a figuré l’augmentation de la mortalité, qui intervient ici lorsque le potentiel descend au-dessous de la valeur P50.


Sommaire :
- I. OUTILS ET CONCEPTS DE BASE
- II. ETATS ET TRANSFERTS HYDRIQUES DANS ET À TRAVERS LA PLANTE
- II.1. La cellule en tant que compartiment hydrique
- Introduction : la cellule végétale vivante
- Le potentiel hydrique de la cellule et ses composantes.
- Relation potentiel hydrique – volume cellulaire : le diagramme de Höfler
- L’osmorégulation
- Les transferts d’eau transmembranaires
- Importance des relations hydriques pour l’expansion cellulaire
- Mesure des composantes du potentiel hydrique cellulaire
- Références bibliographiques
- II.2. Anatomie des voies de transfert de l’eau dans la plante
- II.3. L'eau dans les tissus et les organes de la plante et ses méthodes de caractérisation
- II.4. L’absorption de l'eau du sol par les racines
- II.5. La transpiration foliaire
- II.6. Transferts et états hydriques dans le continuum Sol-Plante-Atmosphère
- II.7. L’architecture hydraulique, la cavitation et l’embolie des plantes
- II.8. Un modèle simple de fonctionnement hydrique à l'échelle de la plante entière. Application pour un arbre
- II.9. Les flux de sève dans la plante : couplage entre xylème et phloème, modélisation
- II.10. L’eau et le métabolisme carboné : C3/C4, CAM ; efficience de l’eau
- II.1. La cellule en tant que compartiment hydrique
- III. FONCTIONNEMENT DES VEGETAUX EN SITUATION DE STRESS LIE A L’EAU
- III.1. Les végétaux face à la sécheresse
- III.2. Efficience agronomique de l’eau
- Les composantes de l’efficience d’utilisation de l’eau par les cultures.
- Nécessité de quantifier séparément Evaporation du sol et Transpiration des plantes
- Les interactions entre nutrition azotée et alimentation hydrique, conséquence sur l’efficience d’utilisation de l’eau par les cultures.
- Références bibliographiques
- IV. AGRONOMIE DE L’EAU
Dans le chapitre :





